| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 肝細胞癌 | 補助化学療法 | 第3相 | 無再発生存期間 | 国際 (アジア、欧州) |
あり |
試験名 :STORM
レジメン:Sorafenib vs プラセボ
登録期間:2008年8月〜2010年11月
背景
肝細胞癌患者に対する補助化学療法の標準治療は確立していない。ソラフェニブ単独療法は、切除不能肝細胞癌に対する一次治療として有効性が示されており、補助化学療法としての有効性と安全性を検討することとした。本試験は切除または局所焼灼による根治治療後の肝細胞癌患者を対象とした第3相試験であり、根治治療後の補助化学療法としてソラフェニブを検討した初の大規模無作為化試験である。
シェーマ
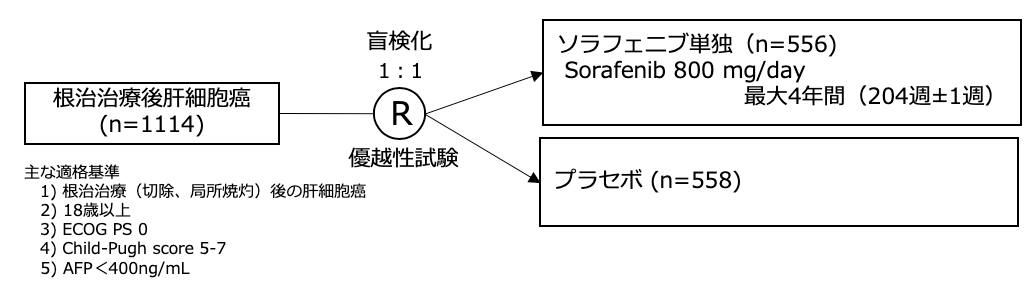
統計学的事項
主要評価項目:無再発生存期間
本試験の主要評価項目は無再発生存期間(RFS)とした。当初、RFSの期待値30%、検出力90%として611イベントが必要とされたが、再発なしでの治療中止患者が予想より多かったため計画を変更することとなり、検出力80%、片側α=0.025と設計直し、 457イベント・1100例の登録が必要と修正された。試験結果:
- 本試験には、アジア・パシフィックと欧州の28ヵ国が参加した。
- 2008年8月から2010年11月までの間に、 202施設から1114例が登録され、ソラフェニブ群とプラセボ群に1:1に割り付けられた。
ITT集団:ソラフェニブ群 556例、プラセボ群 558例 - カットオフ日:2013年11月29日
- 患者の年齢中央値は59歳であった。両群ともに8割が男性(ソラフェニブ群 81%、プラセボ群 83%)、6割がアジア人であった(ソラフェニブ群 63%、プラセボ群 61%)。また両群ともにHBV感染が5割を占めていた(ソラフェニブ群 51%、プラセボ群 47%)。
1. 無再発生存期間:独立中央判定(主要評価項目)
| 中央値 | 95%信頼区間 | HR 0.940 (95%C.I. 0.780-1.134) P = 0.26 |
|
| ソラフェニブ(n=556) | 33.3ヶ月 | 27.6–44.0 | |
| プラセボ(n=558) | 33.7ヶ月 | 27.6–39.0 |
2. 再発までの期間:独立中央判定
| 中央値 | 95%信頼区間 | HR 0.891 (95%C.I. 0.735-1.081) P = 0.12 |
|
| ソラフェニブ(n=556) | 38.5ヶ月 | 30.4–NE | |
| プラセボ(n=558) | 35.8ヶ月 | 30.3-41.4 |
3. 全生存期間
| 中央値 | 95%信頼区間 | HR 0.995 (95%C.I. 0.761-1.300) P = 0.48 |
|
| ソラフェニブ(n=556) | 未達 | - | |
| プラセボ(n=558) | 未達 | - |
4. おもな治療関連有害事象(CTCAE v.3.0)
| ソラフェニブ(n=559) | プラセボ(n=548) | |||||
|---|---|---|---|---|---|---|
| 全Grade | Grade 3 | Grade 4 | 全Grade | Grade 3 | Grade 4 | |
| 手足皮膚反応 | 70% | 28% | - | 5% | <1% | - |
| 下痢 | 38% | 6% | 0 | 7% | <1% | 0 |
| 脱毛 | 32% | - | - | 3% | - | - |
| 高血圧 | 19% | 4% | 0 | 6% | 1% | 0 |
| 皮疹/落屑 | 16% | 3% | <1% | 5% | 0 | 0 |
| 疲労 | 13% | 1% | <1% | 7% | <1% | 0 |
| 体重減少 | 7% | <1% | - | <1% | 0 | - |
結語
ソラフェニブ単独療法は、根治治療後の肝細胞癌に対する補助化学療法としては無再発生存期間の延長は認められず、有効性が示されなかった。
執筆:千葉大学病院 臨床試験部 特任助教 小笠原 定久 先生
監修:神奈川県立がんセンター 消化器内科(肝胆膵) 部長 上野 誠 先生
監修:神奈川県立がんセンター 消化器内科(肝胆膵) 部長 上野 誠 先生