| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 肝細胞癌 | 一次治療 | 第2相 | 無増悪生存期間 全生存期間 |
日本 | あり |
試験名 :TACTICS trial
レジメン:肝動脈化学塞栓術+ソラフェニブ vs 肝動脈化学塞栓術
登録期間:2011年2月〜2016年3月
背景
Intermediate stageの肝細胞癌に対する標準治療として肝動脈化学塞栓術(transarteririal chemoembolisation: TACE)が推奨されているが、TACEを繰り返すことにより肝機能が増悪することが問題となっている。また、TACE後の腫瘍低酸素状態により腫瘍組織内のVEGFが増加し血管新生を促すため、VEGF受容体を含むマルチキナーゼ阻害薬であるソラフェニブ(SFB)を併用することにより、TACE後の腫瘍増大を抑えることできるのではないかと考えられている。これまでにTACE+SFB併用療法の有用性について3つの試験(post-TACE試験、SPACE試験、TACE-2試験)で検討されているが、いずれもTACE+SFB併用療法の有用性を示すことはできなかった。しかし、SFBを長期間投与できた場合はTACEとの併用療法が有用である可能性が示唆された。そこで今回、切除不能肝細胞癌に対して、TACEに特化した新しいエンドポイントを用いてTACE+SFB併用療法とTACE単独を比較した非盲検無作為化比較第2相試験が行われた。
シェーマ
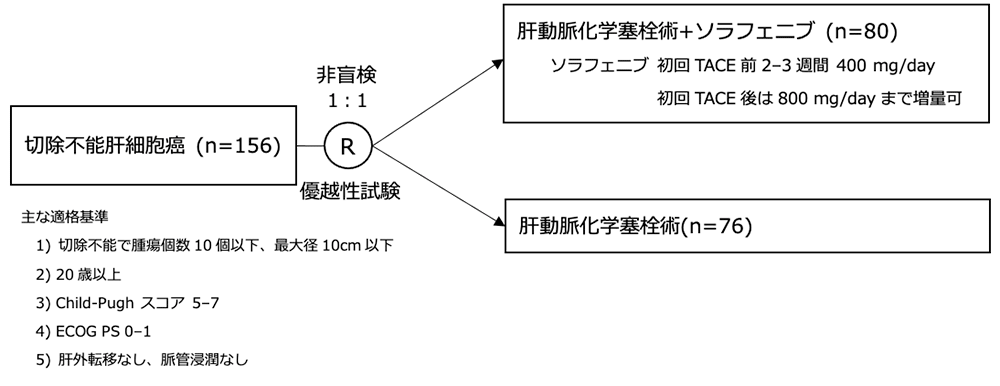
統計学的事項
主要評価項目:無増悪生存期間、全生存期間
本試験はTACE群を対照として、TACE+SFB群の無増悪生存期間のハザード比が0.71となることを検証する優越性試験として設計され、検出力80%、片側 α=0.15とし、168例の登録・125イベントが必要と設定された。無増悪生存期間のp値が0.15未満の場合に限り、全生存期間に関する検定を行うこととされた。無増悪生存期間のイベントは25%以上の腫瘍増大、Child-Pugh Cへの肝機能悪化、主要脈管浸潤や肝外転移の出現、もしくは死亡と定義され、肝内新規病変の出現はイベントに含まれなかった。
試験結果:
- 2018年3月から2019年1月の間に、日本国内33施設から197例が登録され、不適格例を除いた156例のうち80例がTACE+SFB群に、76例がTACE群に割り付けられた。
- 患者背景に大きな隔たりは認められなかった。
1. 無増悪生存期間(主要評価項目)
| 中央値 | HR 0.59 (95%C.I. 0.41–0.87) P=0.006 |
|
| TACE+SFB群 (n=80) | 25.2ヶ月 | |
| TACE群 (n=76) | 13.5ヶ月 |
2. 全生存期間(主要評価項目)
| 中央値 | |
| TACE+SFB群 (n=80) | 未到達 |
| TACE群 (n=76) | 未到達 |
2017年11月時点で、全生存期間のイベント数は92例と予定の125イベントに到達しておらず未解析である。
3. 生存割合
| 1年生存割合 | 2年生存割合 | |
| TACE+SFB群 (n=80) | 96.2% | 77.2% |
| TACE群 (n=76) | 82.7% | 64.6% |
4. TACE治療不能までの期間
| 中央値 | HR 0.57 (95%C.I. 0.36–0.92) P=0.02 |
|
| TACE+SFB群 (n=80) | 26.7ヶ月 | |
| TACE群 (n=76) | 20.6ヶ月 |
5. 腫瘍増悪までの期間
| 中央値 | HR 0.54 (95%C.I. 0.35–0.83) P=0.005 |
|
| TACE+SFB群 (n=80) | 26.7ヶ月 | |
| TACE群 (n=76) | 16.4ヶ月 |
6. 抗腫瘍効果(初回TACE4週間後)
| TACE+SF群 (n=80) | TACE群(n=76) | ||
|---|---|---|---|
| 最良効果 | p=0.77 | ||
| 完全奏効(CR) | 23 (28.8%) | 21 (27.6%) | |
| 部分奏効(PR) | 34 (42.5%) | 26 (34.2%) | |
| 安定(SD) | 10 (12.5%) | 12 (15.8%) | |
| 進行(PD) | 2 (2.5%) | 3 (3.9%) | |
| 評価不能(NE) | 11 (13.8%) | 14 (18.4%) | |
| 奏効割合 | 57 (71.3%) | 47 (61.8%) | p=0.23 |
| 腫瘍制御割合 | 67 (83.8%) | 59 (77.6%) | p=0.42 |
7. 有害事象
| TACE+SFB群(n=77) | TACE群(n=71) | |||||||
|---|---|---|---|---|---|---|---|---|
| Grade | All | 1–2 | 3 | 4 | All | 1–2 | 3 | 4 |
| AST上昇 | 72(93.5%) | 50(64.9%) | 17(22.1%) | 5(6.5%) | 65(91.5%) | 50(70.4%) | 14(19.7%) | 1(1.4%) |
| ALT上昇 | 69(89.6%) | 50(64.9%) | 18(23.4%) | 1(1.3%) | 55(77.5%) | 42(59.2%) | 13(18.3%) | 0(0%) |
| 血小板減少 | 67(87.0%) | 57(74.0%) | 10(13.0%) | 0(0%) | 53(74.6%) | 51(71.8%) | 2(2.8%) | 0(0%) |
| ビリルビン上昇 | 55(71.4%) | 54(70.1%) | 1(1.3%) | 0(0%) | 39(54.9%) | 37(52.1%) | 2(2.8%) | 0(0%) |
| 貧血 | 50(64.9%) | 49(63.6%) | 1(1.3%) | 0(0%) | 35(49.3%) | 34(47.9%) | 1(1.4%) | 0(0%) |
| 手足症候群 | 41(53.2%) | 37(48.1%) | 4(5.2%) | 0(0%) | 0(0%) | 0(0%) | 0(0%) | 0(0%) |
| 高血圧 | 40(51.9%) | 32(41.6%) | 8(10.4%) | 0(0%) | 28(39.4%) | 25(35.2%) | 3(4.2%) | 0(0%) |
| リパーゼ上昇 | 38(49.4%) | 26(33.8%) | 11(14.3%) | 1(1.3%) | 18(25.4%) | 16(22.5%) | 2(2.8%) | 0(0%) |
| 血清アミラーゼ上昇 | 32(41.6%) | 26(33.8%) | 6(7.8%) | 0(0%) | 19(26.8%) | 18(25.4%) | 1(1.4%) | 0(0%) |
| 好中球減少 | 29(37.7%) | 25(32.5%) | 4(5.2%) | 0(0%) | 29(40.8%) | 29(40.8%) | 0(0%) | 0(0%) |
| 白血球減少 | 29(37.7%) | 28(36.4%) | 1(1.3%) | 0(0%) | 26(36.6%) | 26(36.6%) | 0(0%) | 0(0%) |
| 倦怠感 | 20(26.0%) | 20(26.0%) | 0(0%) | 0(0%) | 9(12.7%) | 9(12.7%) | 0(0%) | 0(0%) |
| 疲労 | 19(24.7%) | 17(22.1%) | 2(2.6%) | 0(0%) | 7(9.9%) | 7(9.9%) | 0(0%) | 0(0%) |
| 発熱 | 15(19.5%) | 14(18.2%) | 1(1.3%) | 0(0%) | 18(25.4%) | 18(25.4%) | 0(0%) | 0(0%) |
| 食欲不振 | 11(14.3%) | 9(11.7%) | 2(2.6%) | 0(0%) | 8(11.3%) | 7(9.9%) | 1(1.4%) | 0(0%) |
| 下痢 | 11(14.3%) | 9(11.7%) | 2(2.6%) | 0(0%) | 0(0%) | 0(0%) | 0(0%) | 0(0%) |
| 多形紅斑 | 9(11.7%) | 7(9.1%) | 2(2.6%) | 0(0%) | 0(0%) | 0(0%) | 0(0%) | 0(0%) |
| 体重減少 | 9(11.7%) | 9(11.7%) | 0(0%) | 0(0%) | 2(2.8%) | 2(2.8%) | 0(0%) | 0(0%) |
| 嗄声 | 9(11.7%) | 9(11.7%) | 0(0%) | 0(0%) | 0(0%) | 0(0%) | 0(0%) | 0(0%) |
結語
切除不能肝細胞癌において、TACE+SFB群はTACE群に比べて、有意に無増悪生存期間を延長した。有害事象は以前の類似試験と同等であり、TACE+SFB併用療法は肝外病変や脈管浸潤のない切除不能肝細胞癌患者における治療選択肢の一つになるかもしれない。
執筆:神奈川県立がんセンター 消化器内科・肝胆膵 佐野 裕亮 先生
監修:国立がん研究センター東病院 肝胆膵内科 科長 池田 公史 先生
監修:国立がん研究センター東病院 肝胆膵内科 科長 池田 公史 先生