| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 進展型小細胞肺癌 | 一次治療 | 第3相 | 全生存期間 | 国際 | あり |
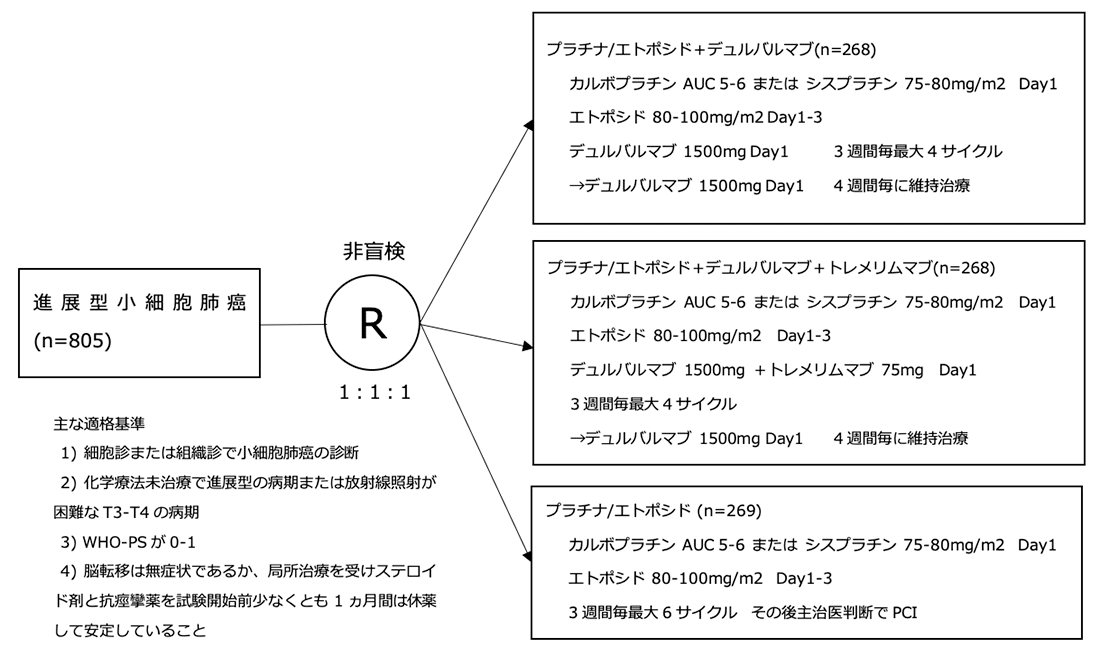
試験名 :CASPIAN
レジメン:プラチナ/エトポシド+デュルバルマブ vs プラチナ/エトポシド
登録期間:2017年3月27日〜2018年5月29日
背景
シェーマ
統計学的事項
主要評価項目:全生存期間
本試験はDurva併用群 vs 化学療法群、またはDurva+トレメリムマブ併用群 vs 化学療法群のいずれかで全生存期間(OS)の優越性を検証する試験である。全生存期間解析と無増悪生存期間解析に関して、ゲートキーピング法による階層的多重検定法が用いられた。両側αを5%として、4%をDurva併用群 vs 化学療法群の全生存期間に、1%をDurva+トレメリムマブ併用群 vs 化学療法群の全生存期間に配分し、無増悪生存期間は、全生存期間の一次解析の両方で有意な結果が得られた場合にのみ解析を実施することした。
Durva併用群 vs 化学療法群の症例設計はHR 0.69、両側α=4%、検出力 96%で必要イベント数は425であり、Durva+トレメリムマブ併用群 vs 化学療法群ではHR 0.69、両側α=1%、検出力 89%で必要イベント数は425であった。中間解析は、Durva併用群と化学療法群の比較、Durva+トレメリムマブ併用群と化学療法群の比較の両方で約318件の死亡イベントが発生した時点で計画された。計画された中間解析においては、全生存期間のHRを0.71と仮定した場合、Durva併用群と化学療法群の比較において、データカットオフ時に観察されたイベント数に基づいて実際のα消費量を算出すると、両側有意水準1.43% (全体のαは4%)で、検出力は71%と推定された。
試験結果:
- 2017年3月27日〜2018年3月29日の期間に23か国209施設より972例が登録され、そのうち167例が除外され、Durva併用群には268例、Durva+トレメリムマブ併用群には268例、化学療法群には269例が無作為に割り付けられた。
- 患者背景の特徴は、両群間で偏りは認められなかった。
- Durva+トレメリムマブ併用群の全生存期間は中間解析時点で事前設定された統計的有意性の閾値に達しておらず、結果は最終解析での報告が予定された。
- 有効性解析のデータカットオフは2019年3月11日。観察期間中央値は14.2ヶ月であった。
- プラチナ製剤の内容は、治療を受けた両群531例のうち416例(78%)がカルボプラチン(CBDCA)、132例(25%)がシスプラチン(CDDP)であった。
- Durva併用群で230例(87%)がプラチナ/ETPの最大4サイクルの投与を受けていた。化学療法群で225例(85%)がプラチナ/ETPの4サイクル以上の投与を受け、151例(57%)が最大6サイクルの投与を受けた。
- Durva併用群で113例(42%)、化学療法群で119例(44%)が1レジメン以上の後治療を受けた。
- 化学療法群では21例(8%)が化学療法後に予防的全脳照射(PCI)を受けた。Durva併用群では予防的全脳照射(PCI)は禁止された。
1. 全生存期間(主要評価項目)
| 中央値 | 95%信頼区間(CI) | HR 0.73 (95%CI:0.59−0.91) p=0.0047 |
|
| Durva併用群 | 13.0ヶ月 | 11.5−14.8 | |
| 化学療法群 | 10.3ヶ月 | 9.3−11.2 |
12ヵ月全生存割合は54%(95%CI:47.4−59.5)vs 40%(33.7−45.8)、18カ月生存割合は34%(95%CI:26.9−41.0)vs 25%(18.4−31.6)であった。
データカットオフ時点で、Durva併用群で155例(58%)、化学療法群で181例(67%)の死亡イベントがあった。
2. 無増悪生存期間
| 中央値 | 95%CI | HR 0.78 (95%CI:0.65−0.94) |
|
| Durva併用群 | 5.1ヶ月 | 4.7−6.2 | |
| 化学療法群 | 5.4ヶ月 | 4.8−6.2 |
無増悪生存期間は、本試験のデザイン上、中間解析の時点では多重検定で有意性を検定することはできなかったが、比較のためのHRは0.78(95%CI:0.65−0.94)であった。
6ヶ月無増悪生存割合は45%(39.3−51.3)対46%(39.3−51.7)、12ヶ月無増悪生存割合は18%(13.1−22.5)対5%(2.4−8.0)であった。
データカットオフ時点で、Durva併用群で226例(84%)、化学療法群で233例(87%)の病勢進行または死亡のイベントがあった。
3. 客観的奏効割合
| 奏効割合 | オッズ比 1.56 (95%CI:1.10−2.22) |
|
| Durva併用群 | 67.9% | |
| 化学療法群 | 57.6% |
奏効期間の中央値はDurva併用群で5.1ヶ月(95%CI:3.4−10.4ヶ月)、化学療法群で5.1ヶ月(95%CI:3.7−6.8ヶ月)であり、両群でほぼ同程度であった
4. 有害事象 (CTCAE Ver4.03)
| DURVA併用群 N=265(%) | 化学療法群 N=266(%) | |||
|---|---|---|---|---|
| Any Grade | Grade 3 or 4 | Any Grade | Grade 3 or 4 | |
| 全有害事象 | 260(98%) | 163(62%) | 258(97%) | 166(62%) |
| 重篤な有害事象 | 82(31%) | 57(22%) | 96(36%) | 70(26%) |
| 中止に繋がった有害事象 | 25(9%) | 7(3%) | 25(9%) | 7(3%) |
| 死亡に繋がった有害事象 | 13(5%) | - | 15(6%) | - |
| 好中球減少症 | 111(42%) | 64(24%) | 124(47%) | 88(33%) |
| 貧血 | 102(38%) | 24(9%) | 125(47%) | 48(18%) |
| 悪心 | 89(34%) | 1(<1%) | 89(33%) | 5(2%) |
| 脱毛 | 83(31%) | 3(1%) | 91(34%) | 2(1%) |
| 便秘 | 44(17%) | 2(1%) | 51(19%) | 0 |
| 食欲減退 | 48(18%) | 2(1%) | 46(17%) | 2(1%) |
| 血小板減少症 | 41(15%) | 15(6%) | 53(20%) | 25(9%) |
| 倦怠感 | 48(18%) | 4(2%) | 45(17%) | 3(1%) |
| 嘔吐 | 39(15%) | 0 | 44(17%) | 3(1%) |
| 無力症 | 40(15%) | 5(2%) | 40(15%) | 3(1%) |
| 白血球減少症 | 40(15%) | 17(6%) | 31(12%) | 14(5%) |
| 呼吸困難 | 31(12%) | 5(2%) | 28(11%) | 3(1%) |
| 好中球数減少 | 26(10%) | 17(6%) | 31(12%) | 17(6%) |
| 下痢 | 26(10%) | 3(1%) | 30(11%) | 3(1%) |
| 咳嗽 | 33(12%) | 2(1%) | 18(7%) | 0 |
| 低ナトリウム血症 | 26(10%) | 10(4%) | 12(5%) | 7(3%) |
| 発熱性好中球減少症 | 17(6%) | 14(5%) | 17(6%) | 17(6%) |
| 白血球数減少 | 14(5%) | 4(2%) | 17(6%) | 6(2%) |
| 血小板数減少 | 16(6%) | 4(2%) | 14(5%) | 6(2%) |
| 肺炎 | 11(4%) | 5(2%) | 18(7%) | 9(3%) |
| 高血圧 | 15(6%) | 8(3%) | 7(3%) | 1(<1%) |
| リパーゼ上昇 | 12(5%) | 9(3%) | 7(3%) | 4(2%) |
| アミラーゼ上昇 | 11(4%) | 6(2%) | 2(1%) | 1(<1%) |
Grade 3−4の有害事象は、Durva併用群で62%、化学療法群で62%であった。治療関連の重篤な有害事象は、Durva併用群で22%、化学療法群で26%であった。投与中止に至る有害事象は各群ともに25例(9%)であった。有害事象による死亡は、Durva併用群で13例(5%)、化学療法群で15例(6%)に認められた。Grade 3−4の有害事象で最も多かったのは好中球減少と貧血であった。
免疫関連有害事象(imAE)は、Durva併用群で52例(20%)、化学療法群で7例(3%)に確認されたが、大多数がGrade1または2であった。Grade 3−4のimAEは、Durva併用群で12人(5%)、化学療法群で1人(1%未満)に認められた。imAEによる死亡は各群で1例(1%未満)であり、死因はDurva併用群では肝毒性、化学療法群では肺炎であった。Durva併用群で頻度の多いimAEは、甲状腺機能低下症(9%)甲状腺機能亢進症(5%)で、いずれもGrade1または2であった。
5. サブグループ解析
Durva併用群のOSにおける有益性は、プラチナ製剤の内容(CBDCA/CDDP)、年齢(<65歳/≥65歳)、性(女性/男性)、ECOG-PS(0/1)、喫煙の有無(喫煙者/非喫煙者)、脳または中枢神経系転移(あり/なし)、病期(III期/IV期)、人種(アジア人/非アジア人)、地域(アジア/ヨーロッパ/ 北南米)など、全てのサブグループ間で一貫して確認された。
監修:神奈川県立循環器呼吸器病センター 呼吸器内科 医長 池田 慧 先生