| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| BRAF V600E変異陽性 非小細胞肺癌 |
既治療 | 第2相 | 奏効割合 | 北アメリカ、ヨーロッパ、アジア | あり |
試験名 :E2201 試験
レジメン:ダブラフェニブ+トラメチニブ
登録期間:2013年12月20日〜2015年1月14日
背景
BRAF V600E遺伝子変異は肺腺癌のおよそ1-2%にみられるドライバー変異であり、BRAF 変異例は予後不良であると報告されている。
E2201試験は、BRAF V600E遺伝子変異を有する切除不能な進行・再発の非小細胞肺癌患者を対象とした、3つのコホートからなる第2相試験である。コホートAでは、選択的BRAF 阻害薬であるダブラフェニブ(DAB)の既治療BRAF V600E陽性非小細胞肺癌に対する有効性が評価され、DAB単剤では奏効割合33%(95% CI 23-45)、無増悪生存期間中央値は5.5ヶ月という結果であった。過去のBRAF V600E陽性切除不能悪性黒色腫を対象とした試験では、BRAF 阻害薬とMEK阻害薬の併用療法は、BRAF 阻害薬単剤と比較して、奏効割合・無増悪生存期間・全生存期間のいずれも良好な治療成績が得られており、また、BRAF 遺伝子変異陽性のヒト肺癌細胞株を用いた前臨床のデータでも、BRAF 阻害薬にMEK阻害薬を併用することで相乗的に抗腫瘍効果が認められている。これらの背景から、E2201試験のコホートBでは既治療、コホートCでは未治療の切除不能BRAF V600E陽性非小細胞肺癌患者を対象として、BRAF 阻害薬のDABとMEK阻害薬のトラメチニブ(TRA)の併用療法の有効性および安全性を評価した。本報告は、コホートBの結果である。
E2201試験は、BRAF V600E遺伝子変異を有する切除不能な進行・再発の非小細胞肺癌患者を対象とした、3つのコホートからなる第2相試験である。コホートAでは、選択的BRAF 阻害薬であるダブラフェニブ(DAB)の既治療BRAF V600E陽性非小細胞肺癌に対する有効性が評価され、DAB単剤では奏効割合33%(95% CI 23-45)、無増悪生存期間中央値は5.5ヶ月という結果であった。過去のBRAF V600E陽性切除不能悪性黒色腫を対象とした試験では、BRAF 阻害薬とMEK阻害薬の併用療法は、BRAF 阻害薬単剤と比較して、奏効割合・無増悪生存期間・全生存期間のいずれも良好な治療成績が得られており、また、BRAF 遺伝子変異陽性のヒト肺癌細胞株を用いた前臨床のデータでも、BRAF 阻害薬にMEK阻害薬を併用することで相乗的に抗腫瘍効果が認められている。これらの背景から、E2201試験のコホートBでは既治療、コホートCでは未治療の切除不能BRAF V600E陽性非小細胞肺癌患者を対象として、BRAF 阻害薬のDABとMEK阻害薬のトラメチニブ(TRA)の併用療法の有効性および安全性を評価した。本報告は、コホートBの結果である。
シェーマ
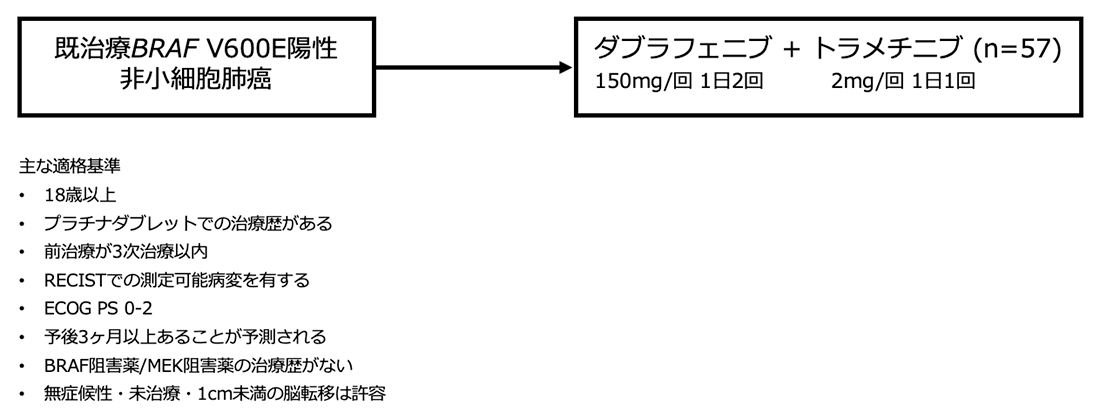
統計学的事項
主要評価項目:奏効割合(治験責任医師による評価)
2段階のGreen-Dahlbergデザインを用いて、臨床的効果を試験中にモニタリングし、十分な効果が示されなかった場合には試験治療は無効と判断して試験を早期中止できるよう設定した。20人の患者が、少なくとも2回の画像評価を受けたか、画像評価前に試験から脱落したことが確認された時点で、中間解析を実施する計画とした。BRAF V600E陽性非小細胞肺癌に対する二次治療から四次治療としてのDAB+TRA併用療法の奏効割合が30%以下とする帰無仮説と、55%以上とする対立仮説を立てた。20症例登録時点で6例以上、40例中18例以上に奏効が確認されなかった場合には試験を無効中止することとした。
統計解析は計画された40例の登録に基づいて行われ、両側α=0.032、検出力を92.2%とした。患者数が想定以上となっても、効果と安全性については統計学的な設定を変えず、ITT集団で評価を行うこととした。
試験結果:
- 2013年12月20日から2015年1月14日までに北アメリカ、ヨーロッパ、アジアの9ヶ国30施設から59人の患者が登録された。2人の初回治療例患者はプロトコール逸脱として扱い別に評価し、57人をDAB+TRAによる治療を受けた評価対象とした。
- 1人の患者が無症候性の測定可能病変のない脳転移を有していた。2015年10月7日のデータカットオフ時点では、57人中21人(37%)が治療継続中だった。28人(49%)が病勢増悪、7人(12%)が有害事象、1人(2%)が患者希望により治療中止されていた。病勢増悪後の治療としては抗がん薬治療が最も多く行われていた。
1. 治療効果
主要評価項目であるDAB+TRAの客観的奏効割合(ORR)は63.2% (57人中36人;95%信頼区間49.3-75.6)だった。全生存期間中央値は、報告時点で未到達だった(※フォローアップ解析時点で18.2ヵ月;95%信頼区間 14.3-NE)。
| 治験責任医師による評価(N=57) | 独立評価(N=57) | |
|---|---|---|
| 最良総合効果 | ||
| 完全奏効(CR) | 2(3.5%) | 0 |
| 部分奏効(PR) | 34(59.6%) | 36(63.2%) |
| 安定(SD) | 9(15.8%) | 4(7.0%) |
| 進行(PD) | 7(12.3%) | 8(14.0%) |
| Non-CR/non-PD | 0 | 3(5.3%) |
| Not evaluable | 5(8.8%) | 6(10.5%) |
| 奏効割合(CR+PR) | 36(63.2%) (95% CI 49.3-75.6) |
36(63.2%) (95% CI 49.3-75.6) |
| 病勢制御割合(CR+PR+SD) | 45(78.9%) (95% CI 66.1-88.6) |
43(75.4%) (95% CI 62.2-85.9) |
| 無増悪生存期間、中央値 | 9.7ヶ月 (95% CI 6.9-19.6) |
8.6ヶ月 (95% CI 5.2-19.1) |
| 奏効期間、中央値 | 9.0ヶ月 (95% CI 6.9-18.3) |
9.0ヶ月 (95% CI 5.8-17.6) |
2. 有害事象
有害事象に伴う投与中止は7人(12%)、投与中断・延期は35人(61%)、薬剤減量は20人(35%)でみられた。DABは33人(58%)、TRAは43人(75%)で予定量の80%以上の投与を行うことができた。56人(98%)が何らかの有害事象を経験し、およそ半分の28人(49%)がGrade3/4の有害事象を経験した。
| GRADE 1-2 | GRADE 3 | GRADE 4 | GRADE 5 | |
|---|---|---|---|---|
| 発熱 | 25(44%) | 1(2%) | 0 | 0 |
| 悪心 | 23(40%) | 0 | 0 | 0 |
| 嘔吐 | 20(35%) | 0 | 0 | 0 |
| 下痢 | 18(32%) | 1(2%) | 0 | 0 |
| 食欲不振 | 17(30%) | 0 | 0 | 0 |
| 倦怠感 | 16(28%) | 2(4%) | 0 | 0 |
| 皮膚乾燥 | 14(25%) | 1(2%) | 0 | 0 |
| 末梢性浮腫 | 13(23%) | 0 | 0 | 0 |
| 悪寒 | 12(21%) | 1(2%) | 0 | 0 |
| 咳嗽 | 12(21%) | 0 | 0 | 0 |
| 皮疹 | 11(19%) | 1(2%) | 0 | 0 |
| 関節痛 | 11(19%) | 0 | 0 | 0 |
| 便秘 | 10(18%) | 0 | 0 | 0 |
| 疲労 | 9(16%) | 1(2%) | 0 | 0 |
| 血中ALP上昇 | 9(16%) | 0 | 0 | 0 |
| 呼吸困難 | 8(14%) | 2(4%) | 0 | 0 |
| そう痒症 | 8(14%) | 1(2%) | 0 | 0 |
| 浮動性めまい | 8(14%) | 0 | 0 | 0 |
| 貧血 | 7(12%) | 2(4%) | 1(2%) | 0 |
| 体重減少 | 7(12%) | 1(2%) | 0 | 0 |
| 上腹部痛 | 7(12%) | 0 | 0 | 0 |
| 低血圧 | 7(12%) | 0 | 0 | 0 |
| 好中球減少症 | 6(11%) | 5(9%) | 0 | 0 |
| 胸痛 | 6(11%) | 0 | 0 | 0 |
| 味覚異常 | 6(11%) | 0 | 0 | 0 |
| 頭痛 | 6(11%) | 0 | 0 | 0 |
| 筋痙攣 | 6(11%) | 0 | 0 | 0 |
| 筋肉痛 | 6(11%) | 0 | 0 | 0 |
| 湿性咳嗽 | 6(11%) | 0 | 0 | 0 |
| 回転性めまい | 6(11%) | 0 | 0 | 0 |
| 過角化 | 5(9%) | 1(2%) | 0 | 0 |
| 体重増加 | 5(9%) | 1(2%) | 0 | 0 |
| 背部痛 | 4(7%) | 0 | 1(2%) | 0 |
| 喀血 | 4(7%) | 1(2%) | 0 | 0 |
| AST上昇 | 3(5%) | 1(2%) | 0 | 0 |
| 血中クレアチニン上昇 | 3(5%) | 1(2%) | 0 | 0 |
| 低リン酸血症 | 3(5%) | 1(2%) | 0 | 0 |
| 血小板数減少 | 3(5%) | 1(2%) | 0 | 0 |
| 低ナトリウム血症 | 2(4%) | 3(5%) | 1(2%) | 0 |
| 白血球数減少 | 2(4%) | 2(4%) | 0 | 0 |
| ALT上昇 | 2(4%) | 1(2%) | 0 | 0 |
| 脱水 | 1(2%) | 2(4%) | 0 | 0 |
| 高血圧 | 1(2%) | 2(4%) | 0 | 0 |
| アミラーゼ上昇 | 1(2%) | 1(2%) | 0 | 0 |
| 基底細胞癌 | 1(2%) | 1(2%) | 0 | 0 |
| 結節性紅斑 | 1(2%) | 1(2%) | 0 | 0 |
| 血尿 | 1(2%) | 1(2%) | 0 | 0 |
| 末梢神経障害 | 1(2%) | 1(2%) | 0 | 0 |
| 疼痛 | 1(2%) | 1(2%) | 0 | 0 |
| 肺塞栓症 | 1(2%) | 1(2%) | 0 | 0 |
| 間質性腎炎 | 1(2%) | 1(2%) | 0 | 0 |
| 視力障害 | 1(2%) | 1(2%) | 0 | 0 |
| G-GTP上昇 | 0 | 1(2%) | 1(2%) | 0 |
| 高カルシウム血症 | 0 | 2(4%) | 0 | 0 |
| 呼吸困難 | 0 | 1(2%) | 0 | 1(2%) |
| 皮膚扁平上皮癌 | 0 | 2(4%) | 0 | 0 |
| CRP上昇 | 0 | 1(2%) | 0 | 0 |
| 急性胆嚢炎 | 0 | 1(2%) | 0 | 0 |
| 冠動脈狭窄 | 0 | 1(2%) | 0 | 0 |
| 発熱性好中球減少症 | 0 | 1(2%) | 0 | 0 |
| 肝細胞癌 | 0 | 1(2%) | 0 | 0 |
| 股関節骨折 | 0 | 1(2%) | 0 | 0 |
| 瘢痕ヘルニア | 0 | 1(2%) | 0 | 0 |
| 腸閉塞 | 0 | 1(2%) | 0 | 0 |
| レジオネラ感染症 | 0 | 0 | 1(2%) | 0 |
| 肺悪性腫瘍 | 0 | 1(2%) | 0 | 0 |
| 悪性腫瘍進行 | 0 | 0 | 0 | 1(2%) |
| 汎血球減少 | 0 | 1(2%) | 0 | 0 |
| 胸水貯留 | 0 | 1(2%) | 0 | 0 |
| 腎盂腎炎 | 0 | 1(2%) | 0 | 0 |
| 四肢麻痺 | 0 | 1(2%) | 0 | 0 |
| 腎不全 | 0 | 1(2%) | 0 | 0 |
| 後腹膜出血 | 0 | 0 | 0 | 1(2%) |
| くも膜下出血 | 0 | 0 | 0 | 1(2%) |
| 心室細動 | 0 | 0 | 1(2%) | 0 |
結語
DAB+TRAの併用療法はBRAF V600E陽性非小細胞肺癌において高い奏効割合と管理可能な毒性を示した新規標的治療である。
執筆:千葉大学医学部附属病院 呼吸器内科 医員 日野 葵 先生
監修:神奈川県立循環器呼吸器病センター 呼吸器内科 医長 池田 慧 先生
監修:神奈川県立循環器呼吸器病センター 呼吸器内科 医長 池田 慧 先生