| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 肺癌 | 一次治療 | 第3相 | 全生存期間 | フランス | なし |
試験名 :IFCT-0501
レジメン:VNR or GEM vs weekly PTX+CBDCA
登録期間:2006年4月〜2009年12月
背景
進行非小細胞肺癌に対するプラチナ併用療法の第3相試験において、高齢者のサブグループ解析ではプラチナ併用療法の全生存期間は、高齢者と若年者で変わらない可能性が示唆されている(Belani CP, et al. Cancer. 2005;104(12):2766-74. Lilenbaum RC, et al. J Clin Oncol. 2005;23(1):190-6. Ansari RH, et al. Crit Rev Oncol Hematol. 2011;78(2):162-71.)。パクリタキセル(PTX) 90 mg/m2を1日目、8日目、15日目に投与し、1日目にAUC 6のカルボプラチン(CBDCA)を4週間毎に投与した第2相試験では、70歳以上の患者で奏効割合が43%、全生存期間中央値が13.6ヵ月と良好な傾向にあった(Pujol JL, et al. J Thorac Oncol. 2006;1(4):328-34.)。Intergroupe Francophone de Cancérologie Thoracique(IFCT)で、70歳~89歳の進行非小細胞肺癌患者を対象に、単剤療法またはプラチナ併用療法に対する優越性を検証する、多施設共同ランダム化第3相試験を実施した。
シェーマ
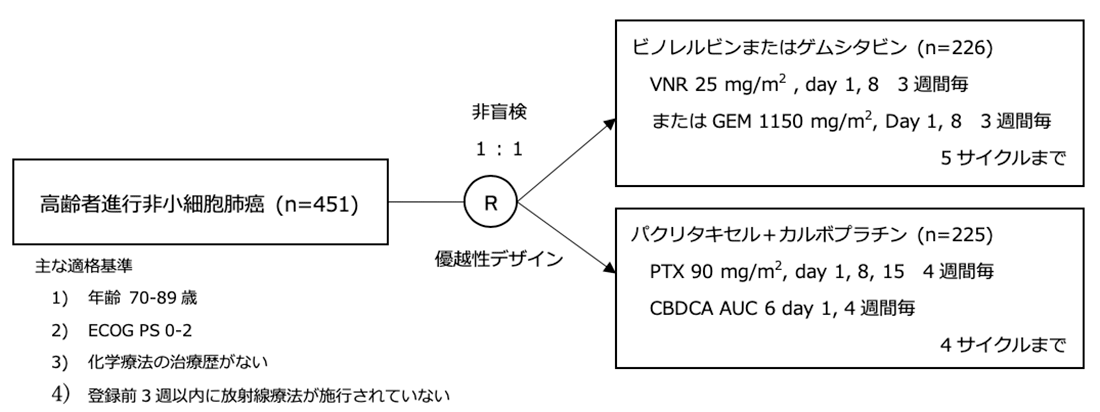
統計学的事項
主要評価項目:全生存期間
本試験の主要評価項目は全生存期間であった。1年生存割合がビノレルビン(VNR)もしくはゲムシタビン(GEM)群(単剤群)で30%(全生存期間中央値7ヵ月)からweekly PTX+CBDCA群で40%(全生存期間中央値9ヵ月)へ10%改善すると仮定し、検出力 80%、αエラーは両側検定で5%と設定し、520例の登録が必要であると計算された。中間解析は、患者の3分の1が登録された後(173例)、予想される死亡数の3分の2の死亡イベントが報告された後(224例)に予定された。安全性評価と主要評価項目の評価を行うために、独立データモニタリング委員会が設置された。全生存期間の評価にはHaybittle Peto法を用い、登録停止にはp=0.0001を必要とすると事前に定められた。
試験結果:
- 2回目の中間解析が2009年12月に実施され、weekly PTX+CBDCA群が有効である可能性が示唆されたため、独立データモニタリング委員会の勧告により症例登録が中止された。
- データカットオフは2010年9月15日であった。追跡期間中央値は30.3ヵ月であった。
- 451例が登録され、単剤群には226例、weekly PTX+CBDCA群には225例が割り付けられ、451例で有効性解析が行われた(単剤群の7例、weekly PTX+CBDCA群の11例は適格性を満たしていなかったもののプロトコル治療を行われていたため、有効性解析に含めた)。
- 患者の同意撤回により単剤群の1例が、全身状態悪化と担当者による撤回によりweekly PTX+CBDCA群の2例が除外され、448例で安全性解析が行われた。
- 年齢中央値は単剤群で76.9歳、weekly PTX+CBDCA群で77.4歳であった。
- 割り付け3ヵ月前からの5%を超える体重減少が単剤群において61.4%、weekly PTX+CBDCA群において47.3%でみられた。
1. 全生存期間(主要評価項目)
| 中央値 | 95%信頼区間 | HR 0.64 (95%CI 0.52-0.78) P<0.0001 |
|
| VNR or GEM | 6.2ヵ月 | 5.3-7.3 | |
| Weekly PTX+CBDCA | 10.3ヵ月 | 8.3-12.6 |
2. 無増悪生存期間
| 中央値 | 95%信頼区間 | HR 0.51 (95%CI 0.42-0.62) P<0.0001 |
|
| VNR or GEM | 2.8ヵ月 | 2.6-3.7 | |
| Weekly PTX+CBDCA | 6.0ヵ月 | 5.5-6.8 |
3. 奏効割合
| 6ヵ月後 | 95%信頼区間 | P<0.0001 | |
| VNR or GEM | 10.2% | 6.6%-14.9% | |
| Weekly PTX+CBDCA | 27.1% | 21.4%-33.4% |
4. 有害事象
| VNR or GEM (n=225) | Weekly PTX+CBDCA (n=223) | |||
|---|---|---|---|---|
| Grade 3 | Grade 4 | Grade 3 | Grade 4 | |
| 好中球数減少 | 6.7% | 5.8% | 30.9% | 17.5% |
| ヘモグロビン減少 | 4.4% | 0% | 9.4% | 0% |
| 発熱性好中球減少 | 1.3% | 1.3% | 5.4% | 4.0% |
| 血小板数減少 | 0.9% | 0% | 4.9% | 1.8% |
| 無力 | 5.8% | 0% | 9.0% | 1.3% |
| 食欲不振 | 0.9% | 0% | 4.0% | 0% |
| 全身状態悪化 | 1.8% | 0% | 1.8% | 0.4% |
| 下痢 | 0.9% | 0.9% | 2.7% | 0% |
| 悪心・嘔吐 | 0.9% | 0% | 2.7% | 0% |
| 肺疾患 | 2.2% | 0% | 1.3% | 0% |
| 感覚神経障害 | 0.4% | 0% | 3.1% | 0% |
| 口内炎 | 0.9% | 0.9% | 0.9% | 0% |
| 便秘 | 0.9% | 0.9% | 0.4% | 0% |
| 呼吸困難 | 0.4% | 0% | 0.4% | 0% |
| 感染 | 0.4% | 0% | 0.4% | 0% |
| 肺塞栓 | 0% | 0% | 0% | 0.9% |
| 気管支炎 | 0% | 0% | 0.4% | 0% |
| GGT上昇 | 0% | 0% | 0.4% | 0% |
| 表在性静脈炎 | 0% | 0% | 0.4% | 0% |
治療関連死:単剤群 3例(1.3%)、weekly PTX+CBDCA群 10例(4.4%)
結語
70歳以上の高齢非小細胞肺癌に対して、weekly PTX+CBDCA療法は毒性が増加したもののVNRもしくはGEM療法と比較し、有意に生存期間を延長することが示された。
ただし、対象群であったVNRもしくはGEM療法が、論文発表時点での本邦での高齢の進行非小細胞肺癌に対しての標準療法であったドセタキセル療法でなかったこと、VNRもしくはGEM療法が5サイクルまでの投与に制限されていたこと、weekly PTX+CBDCA療法の治療関連死が高率であったことから、weekly PTX+CBDCA療法は、我が国では実地診療における標準治療としては受け入れられることが難しかった印象がある。
ただし、対象群であったVNRもしくはGEM療法が、論文発表時点での本邦での高齢の進行非小細胞肺癌に対しての標準療法であったドセタキセル療法でなかったこと、VNRもしくはGEM療法が5サイクルまでの投与に制限されていたこと、weekly PTX+CBDCA療法の治療関連死が高率であったことから、weekly PTX+CBDCA療法は、我が国では実地診療における標準治療としては受け入れられることが難しかった印象がある。
執筆:厚木市立病院 呼吸器内科 医長 田村 休応 先生
監修:国立がん研究センター中央病院 呼吸器内科 医員 大熊 裕介 先生
監修:国立がん研究センター中央病院 呼吸器内科 医員 大熊 裕介 先生