| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 非小細胞肺癌 | 一次治療 | 第3相 | 無増悪生存期間 全生存期間 |
国際 | なし |
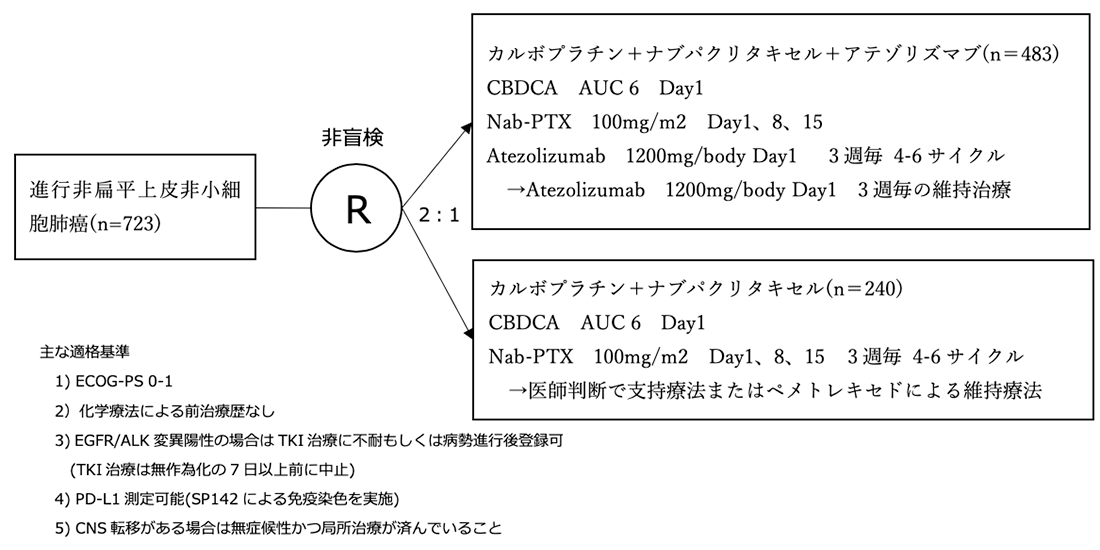
試験名 :IMpower130
レジメン:CBDCA+nab-PTX+Atezolizumab vs CBDCA+nab-PTX
登録期間:2015年4月〜2017年2月
背景
シェーマ
統計学的事項
主要評価項目:EGFR/ALK遺伝子野生型集団における無増悪生存期間、全生存期間
本試験はEGFR/ALK遺伝子野生型集団において、化学療法群を対照として、アテゾリズマブ併用群の無増悪生存期間(PFS)と全生存期間(OS)の優越性を検証する試験である。PFSは検出力95%、両側α=0.006でアテゾリズマブ併用群のハザード比が0.65となること、OSは検出力80%、両側α=0.044の設定でアテゾリズマブ併用群のハザード比が0.75となることを見込んだ。PFSの一次解析で有意差がついた場合、PFS解析からリサイクルされたαとともに割り当てられたαでOSの一次解析を行う事とした。EGFR/ALK遺伝子野生型野生型の進行非扁平上皮非小細胞肺癌650例を集積するため、全体で約 715 例を目標に症例集積を行った。
PFSの最終解析とOSの中間解析は、EGFR/ALK遺伝子野生型集団で約352件のOSイベントが起きた時点で行う計画とした。
試験結果:
- 2015年4月16日から2017年2月13日の期間に131施設より724例が登録され、723例がITT集団に含まれた。1例はランダム化前に死亡しITT集団から除外された。アテゾリズマブ+化学療法群には483例、化学療法単独群には240例が割り付けられた。EGFR/ALK遺伝子野生型集団はアテゾリズマブ+化学療法群は451例、化学療法単独群は228例で構成された。
- 患者背景の特徴は、PD-L1の発現率を含め、両群間で偏りは認められなかった。
- 有効性解析のデータカットオフは2018年3月15日。フォローアップ期間中央値はアテゾリズマブ+化学療法群が18.5ヶ月、化学療法単独群が19.2ヶ月であり両群間に差はなかった。
- 化学療法群では、228例中135例(59%)が病勢進行後にアテゾリズマブを含む免疫チェックポイント阻害剤による治療を受けた。
1. 無増悪生存期間(主要評価項目)
| 中央値 | 95%信頼区間(CI) | HR 0.64 (95%CI:0.54−0.77) P<0.001 |
|
| アテゾリズマブ併用群 | 7.0ヶ月 | 6.2−7.3ヶ月 | |
| 化学療法群 | 5.5ヶ月 | 4.4−5.9ヶ月 |
データカットオフ時点で、アテゾリズマブ+化学療法群451例中347例(77%)、化学療法群228例中198例(87%)にPFSイベントが発生した。
2. 全生存期間(主要評価項目)
| 中央値 | 95%信頼区間(CI) | HR 0.79 (95%CI:0.64−0.98) p=0.033 |
|
| アテゾリズマブ併用群 | 18.6ヶ月 | 16.0−21.2ヶ月 | |
| 化学療法群 | 13.9ヶ月 | 12.0−8.7ヶ月 |
データカットオフ時点で、アテゾリズマブ+化学療法群451例中226例(50%)、化学療法群228例中131例(57%)が死亡した。
3. 奏効割合
| 奏効割合 | 95%CI | オッズ比2.07 (95%CI:1.48−2.89) |
|
| アテゾリズマブ併用群 | 49.2% | 44.5−54.0% | |
| 併用群 | 31.9% | 25.8−38.4% |
奏効期間中央値は、アテゾリズマブ併用群が8.4ヶ月(95%CI:6.9−11.8ヶ月)、化学療法群が6.1ヵ月(95%CI:5.5−7.9ヶ月)であり、アテゾリズマブ併用群の方が長かった。
4. 有害事象
| アテゾリズマブ併用群 (N=473) | 化学療法群(N=232) | |||||||
|---|---|---|---|---|---|---|---|---|
| Grade 1-2 | Grade 3 | Grade 4 | Grade 5 | Grade 1-2 | Grade 3 | Grade 4 | Grade 5 | |
| 治療関連有害事象 | 101 (21%) | 237 (50%) | 109 (23%) | 8 (2%) | 74 (32%) | 109 (23%) | 31 (13%) | 1 (<1%) |
| 好中球減少症 | 66 (14%) | 92 (19%) | 60 (13%) | 0 | 39 (17%) | 47 (20%) | 18 (8%) | 0 |
| 貧血 | 110 (23%) | 138 (29%) | 0 | 0 | 62 (27%) | 46 (20%) | 1 (<1%) | 0 |
| 好中球数低下 | 36 (8%) | 37 (8%) | 20 (4%) | 0 | 14 (6%) | 11 (5%) | 8 (3%) | 0 |
| 血小板減少症 | 82 (17%) | 30 (6%) | 15 (3%) | 0 | 43 (19%) | 12 (5%) | 3 (1%) | 0 |
| 倦怠感 | 156 (33%) | 28 (6%) | 1 (<1%) | 0 | 77 (33%) | 14(6%) | 0 | 0 |
| 白血球減少 | 20 (4%) | 25 (5%) | 6 (1%) | 0 | 10 (4%) | 6 (3%) | 1 (<1%) | 0 |
| 下痢 | 127 (27%) | 22 (5%) | 1 (<1%) | 0 | 44 (19%) | 11 (5%) | 0 | 0 |
| 嘔気 | 194 (41%) | 13 (3%) | 0 | 0 | 92 (40%) | 4 (2%) | 0 | 0 |
| 嘔吐 | 90 (19%) | 9 (2%) | 0 | 0 | 30 (13%) | 3 (1%) | 0 | 0 |
| 無力症 | 52 (11%) | 9 (2%) | 0 | 0 | 28 (12%) | 3 (1%) | 0 | 0 |
| 食欲減退 | 100 (21%) | 7 (1%) | 0 | 0 | 42 (18%) | 4 (2%) | 0 | 0 |
| 低マグネシウム血症 | 57 (12%) | 4 (1%) | 1 (<1%) | 0 | 21 (9%) | 3 (1%) | 0 | 0 |
| 便秘 | 72 (15%) | 1 (<1%) | 0 | 0 | 33 (14%) | 0 | 0 | 0 |
| 脱毛 | 145 (31%) | 0 | 0 | 0 | 61 (26%) | 0 | 0 | 0 |
| 味覚障害 | 51 (11%) | 0 | 0 | 0 | 11 (5%) | 0 | 0 | 0 |
Grade 3−4の有害事象は、アテゾリズマブ併用群で81%、化学療法群で71%であった。治療関連の重篤な有害事象は、アテゾリズマブ併用群で24%、化学療法群で13%であった。治療関連による死亡は、アテゾリズマブ併用群で473例中8例(2%)、化学療法群で232例中1例(1%未満)であった。
投与中止に至る有害事象は、アテゾリズマブ併用群で26%、化学療法群で22%であった。投与中止に至った最も一般的な有害事象は、血小板減少、好中球減少、疲労であった。
免疫関連有害事象はアテゾリズマブ併用群の45%で報告されたが、大多数がGrade1−2であった。頻度の多い免疫関連有害事象は、発疹24%、甲状腺機能低下症15%、肝炎10%であった。
5. サブグループ解析(PFS・OS)
- 無増悪生存期間のサブグループ解析では、PD-L1の発現レベルにかかわらずアテゾリズマブと化学療法を併用したことによる有益性が確認された。(PD-L1高発現のHR 0.51[95%CI:0.34−0.77]、PD-L1低発現のHR 0.61[95%CI:0.43−0.85]、PD-L1陰性のHR 0.72[95%CI:0.56−0.91])
- 全生存期間のサブグループ解析では、無増悪生存期間での解析結果と異なり、全てのPD-L1の発現レベルにおいて、アテゾリズマブと化学療法を併用したことによる有益性は確認されなかった。(PD-L1高発現のHR 0.84[95%CI:0.51−1.39]、PD-L1低発現のHR 0.70[95%CI:0.45−1.08]、PD-L1陰性のHR 0.81[95%CI:0.61−1.08])。化学療法群の59%が病勢進行後にアテゾリズマブを含む免疫チェックポイント阻害剤による治療を受けていることが一因である可能性がある。
- 肝転移患者においては、無増悪生存期間と生存期間のいずれにおいてもアテゾリズマブ併用群での有益性は確認されなかった。
監修:神奈川県立循環器呼吸器病センター 呼吸器内科 医長 池田 慧 先生