| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 進展型小細胞肺癌 | 一次治療 | 第3相 | 全生存期間 | 国際 | あり |
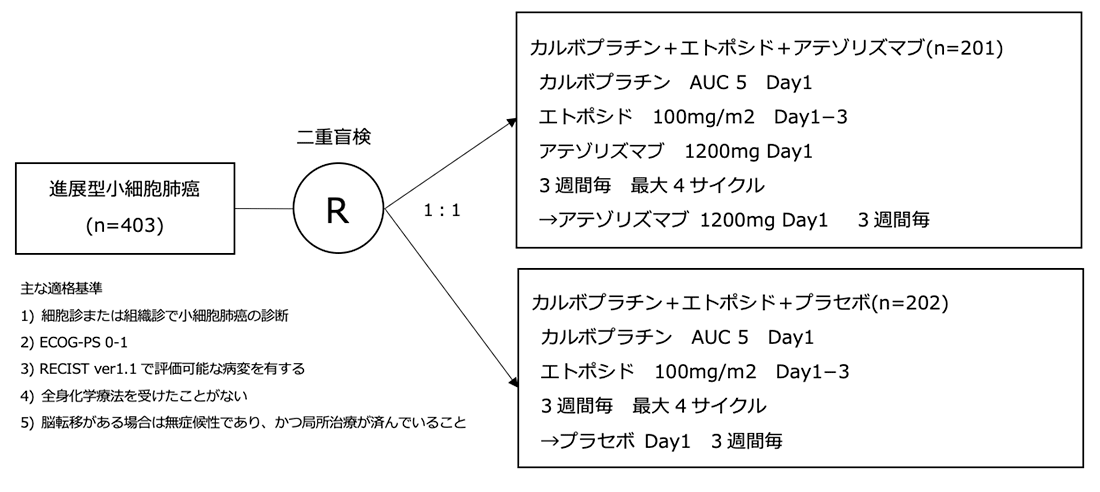
試験名 :IMpower133
レジメン:カルボプラチン+エトポシド+アテゾリズマブ vs カルボプラチン+エトポシド
登録期間:2016年6月6日〜2017年5月31日
背景
シェーマ
統計学的事項
主要評価項目:無増悪生存期間と全生存期間
主要評価項目は無増悪生存期間(PFS)と全生存期間(OS)である。全体での両側αエラーを0.05に制御するため、PFSには両側α=0.005、OSには両側α=0.045がそれぞれの一次解析に割り当てられた。どちらか一方の検定が統計的に有意であった場合、最初に割り当てられたαでは有意でなかった検定へそのαを再利用できる設定とされた。症例数設計は生存期間差の推定によって行われた。プラセボ併用群と比較してAtezo併用群による死亡のハザード比が0.68であることを検証するために、両側α=0.045で検出力を91%と設定すると、OSイベント数は306例が必要と見込まれた。OSの中間解析は、238人の死亡が発生した時点で行い、その際にPFSの一次解析も行う計画とした。試験結果:
- 2016年6月6日〜2017年5月31日の期間に21カ国106施設より403例が登録され、Atezo併用群には201例、プラセボ併用群には202例が無作為に割り付けられた。
- 患者背景の特徴は、両群間で偏りは認められなかった。
- 有効性解析のデータカットオフは2018年4月24日。観察期間の中央値は13.9ヵ月であった。
- 両群ともに22例が予防的全脳照射を受けた。
- Atezo併用群で104例、プラセボ併用群で116例が1レジメン以上の後治療を受けた。プラセボ併用群では15例が後治療として免疫チェックポイント阻害剤を投与された。
- 第1相試験は、Atezo併用療法の有害事象のプロファイルを確立するための期間であり、少なくとも12人の患者が各群に割り付けられ、2サイクル以上の治療を受けた。Atezo併用療法で新たな有害事象は出現せず、既知の安全性プロファイルと一致していた。
1. 全生存期間(主要評価項目)
| 中央値 | 95%信頼区間(CI) | HR 0.70 (95%CI:0.54−0.91) p=0.007 |
|
| Atezo併用 | 12.3ヶ月 | 10.8−15.9ヶ月 | |
| プラセボ併用 | 10.3ヶ月 | 9.3−11.3ヶ月 |
データカットオフ時点で、Atezo併用群201例中104例(51.7%)、プラセボ併用群202例中134例(66.3%)が死亡した。
2. 無増悪生存期間
| 中央値 | 95%CI | HR 0.77 (95%CI:0.62−0.96) p=0.02 |
|
| Atezo併用 | 5.2ヶ月 | 4.4−5.6ヶ月 | |
| プラセボ併用 | 4.3ヶ月 | 4.2−4.5ヶ月 |
データカットオフ時点で、Atezo併用群201例中171例(85.1%)、プラセボ併用群202例中189例(93.6%)に病勢進行または死亡のイベントが発生した。
3. 奏効割合
| 奏効割合 | 95%CI | |
| Atezo併用 | 60.2% | 53.1−67.0% |
| プラセボ併用 | 64.4% | 57.3−71.0% |
Atezo併用群では5例(2.5%)、プラセボ併用群では2例(1.0%)に完全奏効が認められた。
奏効期間の中央値はAtezo併用群で4.2ヶ月(95%CI:1.4−19.5ヶ月)、プラセボ併用群で3.9ヶ月(95%CI:2.0−16.1ヶ月)であり、両群でほぼ同程度であった。
4. 有害事象 (CTCAE ver4.0)
| ATEZO併用 N=198 (%) | プラセボ併用 N=196 (%) | |||||
|---|---|---|---|---|---|---|
| Grade 1 or 2 | Grade 3 or 4 | Grade 5 | Grade 1 or 2 | Grade 3 or 4 | Grade 5 | |
| 全有害事象 | 73(36.9) | 112(56.6) | 3(1.5) | 68(34.7) | 110(56.1) | 3(1.5) |
| 好中球減少症 | 26(13.1) | 45(22.7) | 1(0.5) | 20(10.2) | 48(24.5) | 0 |
| 貧血 | 49(24.7) | 28(14.1) | 0 | 41(20.9) | 24(12.2) | 0 |
| 脱毛 | 69(34.8) | 0 | 0 | 66(33.7) | 0 | 0 |
| 嘔気 | 62(31.3) | 1(0.5) | 0 | 58(29.6) | 1(0.5) | 0 |
| 疲労 | 39(19.7) | 3(1.5) | 0 | 37(18.9) | 1(0.5) | 0 |
| 好中球数低下 | 7(3.5) | 28(14.1) | 0 | 12(6.1) | 33(16.8) | 0 |
| 食思不振 | 39(19.7) | 2(1.0) | 0 | 26(13.3) | 0 | 0 |
| 血小板減少症 | 12(6.1) | 20(10.1) | 0 | 14(7.1) | 15(7.7) | 0 |
| 血小板数低下 | 17(8.6) | 7(3.5) | 0 | 21(10.7) | 7(3.6) | 0 |
| 嘔吐 | 25(12.6) | 2(1.0) | 0 | 19(9.7) | 3(1.5) | 0 |
| 便秘 | 19(9.6) | 1(0.5) | 0 | 25(12.8) | 0 | 0 |
| 白血球減少症 | 15(7.6) | 10(5.1) | 0 | 10(5.1) | 8(4.1) | 0 |
| 白血球数低下 | 10(5.1) | 6(3.0) | 0 | 16(8.2) | 9(4.6) | 0 |
| 下痢 | 15(7.6) | 4(2.0) | 0 | 18(9.2) | 1(0.5) | 0 |
| 発熱性好中球減少症 | 0 | 6(3.0) | 0 | 0 | 12(6.1) | 0 |
| インフュージョンリアクション | 6(3.0) | 4(2.0) | 0 | 9(4.6) | 1(0.5) | 0 |
Grade3−4の有害事象で最も頻度が高かったのは、好中球減少症、貧血であった。
治療関連の死亡は、Atezo併用群で3例(1.5%)(原因は好中球減少症1例、肺炎1例、原因不明1例)、プラセボ併用群で3例(1.5%)(原因は肺炎1例、敗血症性ショック1例、心肺機能不全1例)であった。免疫関連有害事象は、Atezo併用群で39.9%、プラセボ併用群で24.5%に発現した。
Atezo併用群で高頻度に発現した免疫関連有害事象は、発疹(18.7%)と甲状腺機能低下症(12.6%)であった。
5. サブグループ解析
- Atezo併用によるOSおよびPFSに関する有益性は、サブグループ間で一貫していた。
- OSのサブグループ解析において、年齢が65歳未満の患者ではHR 0.92(95%CI:0.64−1.32)、ECOG-PS 0の患者ではHR 0.79(95%CI:0.49−1.27)、脳転移のある患者ではHR 1.07(95%CI:0.47−2.43)、肝転移のある患者ではHR 0.81(95%CI:0.55−1.20)という結果であったが、探索的な解析であり慎重な解釈を要する。
- 全患者のうち374人(92.8%)が腫瘍のTumor mutational burden(TMB)の分析に使用できる血漿を有しており、351人(93.8%)から分析に使用できる質の高いデータが得られた。あらかじめ規定されたTMBのカットオフ値(メガベースあたり10または16の変異数)では、いずれもAtezo投与の有益性を予測できる結果は得られなかった。
監修:神奈川県立循環器呼吸器病センター 呼吸器内科 医長 池田 慧 先生