| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 非扁平上皮非小細胞肺癌 | 一次治療 | 第3相 | 無増悪生存期間/全生存期間 | 国際 | あり |
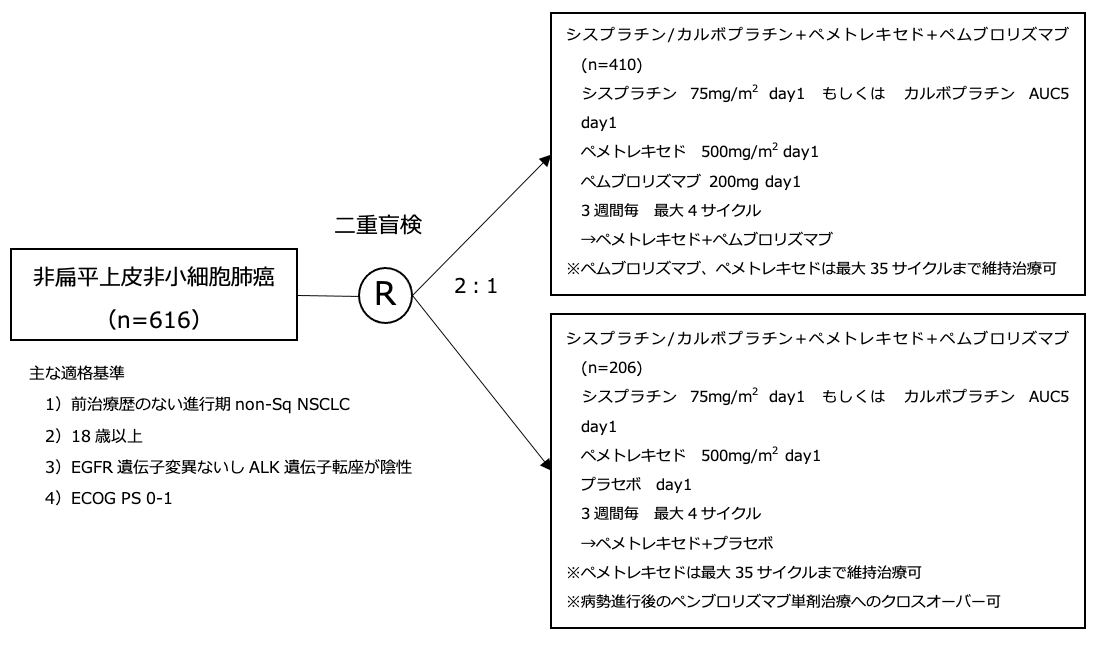
試験名 :KEYNOTE-189
レジメン:プラチナ併用化学療法+ペムブロリズマブ vs プラチナ併用化学療法+プラセボ
登録期間:2016年2月26日〜2017年3月6日
背景
ドライバー遺伝子変異のないPD-L1腫瘍発現割合(TPS)≧50%の非小細胞肺癌の一次治療ではペムブロリズマブ(Pemb)単剤が標準治療となっている。未治療非扁平上皮非小細胞肺癌(non-Sq NSCLC)患者を対象としてPembとプラチナ併用化学療法の併用の有用性を検討した第2相試験(KEYNOTE021G試験)において、併用療法は奏効割合と無増悪生存期間を延長させる可能性が示されたが、第3相試験による検証が必要である。本試験は、未治療進行再発non-Sq NSCLCに対してプラチナ併用化学療法とPembの併用療法の有効性を検証する第3相試験である。
シェーマ
統計学的事項
主要評価項目:
本試験の主要評価項目は全生存期間(OS)と無増悪生存期間(PFS)であった。副次評価項目は奏効割合、奏効期間、安全性、探索的評価項目は、PD-L1発現割合に応じた有効性やアウトカムとされた。有効性は無作為化したすべての患者(intention-to-treatment population)、安全性は割り付けられた治験薬を1回以上投与されたすべての患者(as-treated population)で解析が行われた。OSとPFSはKaplan-Meier法を、群間比較には層別ログランク検定が用いられた。ハザード比と95%信頼区間には層別Cox比例ハザードモデルが使用された。PFSのイベントに関しては、αを片側0.0095、Pemb併用群のプラセボ併用群に対するハザード比0.70と設定すると、468例のイベント観察により検出力は90%が確保されると算出された。また、OSのイベントに関しては、αを片側0.0155、ハザード比0.70と設定すると、416例のイベントの観察により検出力は90%が確保されると算出した。以上から、570例の患者集積が必要と計算された。
2017年11月8日をカットオフとした1回目の中間解析では、進行または死亡のイベントは410例、死亡のイベントは235例観察された時点で実施された。多重性の調整のため、PFSのαは片側0.00559、OSのαは0.00128を有意水準として解析が実施された。この中間解析においてOS及びPFSの有効性のカットオフを上回ったことから早期有効中止とされ、さらにはアウトカムを継続して評価するための追加のフォローアップが行われている。本論文のデータは1回目の中間解析結果に基づいたものである。
試験結果:
- 2016年2月26日~2017年3月6日に118施設の616症例が登録され、Pemb併用群に410例、プラセボ併用群に206例が割り付けられた。
- Pemb併用群で男性の割合が多かったが(62.0% vs 52.9%)、その他の臨床背景では両群に大きな違いは見られなかった。
- 有効性解析のデータカットオフ時(2017年11月8日)に、Pemb併用群のうち405例中137例(33.8%)、プラセボ併用群のうち202例中36例(17.8%)が割り当てられた一次治療が継続されていた。
- プラセボ併用群のうち206例中67例(32.5%)でPemb単剤へクロスオーバーされていた。
- 追跡期間中央値は10.5ヵ月 (範囲: 0.2-20.4ヵ月) であった。
1. 全生存期間(主要評価項目)
| 中央値 | 95%信頼区間 | HR 0.49(0.38-0.64) P<0.001 |
|
| Pemb併用群 | NR | NR | |
| プラセボ併用群 | 11.3ヶ月 | 8.7-15.1ヶ月 |
NR: not reached
- 登録から12ヶ月時点での生存割合は、Pemb併用群で69.2%(64.1-73.8%)、プラセボ併用群で49.4%(42.1-56.2%)であった。
- 12ヶ月時点の生存割合におけるPD-L1発現割合のサブグループ解析では、PD-L1 TPS≧50%ではPemb群73.0% vsプラセボ併用群 48.1%(ハザード比0.55(0.26-0.68))、1-49%の群で71.5% vs 50.9%(ハザード比0.55(0.34-0.90))、1%未満で61.7% vs 52.2%(ハザード比0.59(0.38-0.92))であった。
2. 無増悪生存期間(主要評価項目)
| 中央値 | 95%信頼区間 | HR 0.52(0.43-0.64) P<0.001 |
|
| Pemb併用群 | 8.8ヶ月 | 7.6-9.2 | |
| プラセボ併用群 | 4.9ヶ月 | 4.7-5.5 |
- 登録から12ヶ月時点での無増悪生存割合は、Pemb併用群で34.1%(28.8-39.5)、プラセボ併用群で17.3%(12.0-23.5)であった。
- PD-L1 TPS 1%未満を対象にしたサブグループ解析では、無増悪生存期間の中央値は、Pemb併用群で6.1ヶ月 vs プラセボ併用群5.1ヶ月(ハザード比0.75(0.53-1.05))であり、ハザード比の95%信頼区間が1をまたいでいた。
3. 客観的奏効割合
| 中央値 | 95%信頼区間 | P<0.001 | |
| Pemb併用群 | 47.6% | 42.6-52.5 | |
| プラセボ併用群 | 18.9% | 13.8-25.0 |
4. 奏効期間
| 奏効期間中央値 | 範囲 | |
|---|---|---|
| Pemb併用群 | 11.2ヶ月 | 1.1+*-18.0+ |
| プラセボ併用群 | 7.8ヶ月 | 2.1+-16.4+ |
*「+」はデータカットオフの時点で病勢増悪がみられないことを示す。
5. 有害事象
| Pemb併用群(N=405) | プラセボ併用群(N=202) | |||
|---|---|---|---|---|
| Any Grade | Grade 3,4,5 | Any Grade | Grade 3,4,5 | |
| 治療関連有害事象 | ||||
| 全有害事象 | 404(99.8%) | 272(67.2%) | 200(99.0%) | 133(65.8%) |
| 全ての治療中止につながった有害事象 | 56(13.8%) | 48(11.9%) | 16(7.9%) | 14(6.9%) |
| 何らかの治療中止につながった有害事象 | 112(27.7%) | 81(20.0%) | 30(14.9%) | 22(10.9%) |
| Pembまたはプラセボの中止につながった有害事象 | 82(20.2%) | 64(15.8%) | 21(10.4%) | 17(8.4%) |
| ペメトレキセドの中止につながった有害事象 | 93(23.0%) | 69(17.0%) | 23(11.4%) | 17(8.4%) |
| カルボプラチンまたはシスプラチン の中止につながった有害事象 |
31(7.7%) | 27(6.7%) | 12(5.9%) | 10(5.0%) |
| 死亡につながった有害事象 | 27(6.7%) | 27(6.7%) | 12(5.9%) | 12(5.9%) |
| 15%以上に生じた有害事象 | ||||
| 悪心 | 225(55.6%) | 14(3.5%) | 105(52.0%) | 7(3.5%) |
| 貧血 | 187(46.2%) | 66(16.3%) | 94(46.5%) | 31(15.3%) |
| 疲労 | 165(40.7%) | 23(5.7%) | 77(38.1%) | 5(2.5%) |
| 便秘 | 141(34.8%) | 4(1.0%) | 64(31.7%) | 1(0.5%) |
| 下痢 | 125(30.9%) | 21(5.2%) | 43(21.3%) | 6(3.0%) |
| 食欲不振 | 114(28.1%) | 6(1.5%) | 61(30.2%) | 1(0.5%) |
| 好中球減少症 | 110(27.2%) | 64(15.8%) | 49(24.3%) | 24(11.9%) |
| 嘔吐 | 98(24.2%) | 15(3.7%) | 47(23.3%) | 6(3.0%) |
| 咳嗽 | 87(21.5%) | 0 | 57(28.2%) | 0 |
| 呼吸困難 | 86(21.2%) | 15(3.7%) | 52(25.7%) | 11(5.4%) |
| 衰弱 | 83(20.5%) | 25(6.2%) | 49(24.3%) | 7(3.5%) |
| 皮疹 | 82(20.2%) | 7(1.7%) | 23(11.4%) | 3(1.5%) |
| 発熱 | 79(19.5%) | 1(0.2%) | 30(14.9%) | 0 |
| 末梢性浮腫 | 78(19.3%) | 1(0.2%) | 26(12.9%) | 0 |
| 血小板減少症 | 73(18.0%) | 32(7.9%) | 29(14.4%) | 14(6.9%) |
| 流涙の増加 | 69(17.0%) | 0 | 22(10.9%) | 0 |
| 免疫関連有害事象 | ||||
| 全有害事象 | 92(22.7%) | 36(8.9%) | 24(11.9%) | 9(4.5%) |
| 甲状腺機能低下症 | 27(6.7%) | 2(0.5%) | 5(2.5%) | 0 |
| 肺臓炎 | 18(4.4%) | 11(2.7%) | 5(2.5%) | 4(2.0%) |
| 甲状腺機能亢進症 | 16(4.0%) | 0 | 6(3.0%) | 0 |
| インヒュージョンリアクション | 10(2.5%) | 1(0.2%) | 2(1.0%) | 0 |
| 大腸炎 | 9(2.2%) | 3(0.7%) | 0 | 0 |
| 重症皮膚反応 | 8(2.0%) | 8(2.0%) | 5(2.5%) | 4(2.0%) |
| 腎炎 | 7(1.7%) | 6(1.5%) | 0 | 0 |
| 肝炎 | 5(1.2%) | 4(1.0%) | 0 | 0 |
| 下垂体炎 | 3(0.7%) | 0 | 0 | 0 |
| 膵炎 | 3(0.7%) | 2(0.5%) | 0 | 0 |
| 副腎不全 | 1(0.2%) | 1(0.2%) | 1(0.5%) | 1(0.5%) |
| 筋炎 | 1(0.2%) | 0 | 0 | 0 |
| 甲状腺炎 | 1(0.2%) | 0 | 0 | 0 |
| Ⅰ型糖尿病 | 1(0.2%) | 1(0.2%) | 0 | 0 |
結語
ALK遺伝子転座またはEGFR遺伝子変異のない進行非扁平上皮非小細胞肺癌患者の一次治療において、Pembとプラチナ+ペメトレキセドの併用療法は、プラチナ+ペメトレキセド療法単独と比較して有意に無増悪生存期間、及び全生存期間を延長した。
関連論文
1) Reck M, et al, Pembrolizumab versus Chemotherapy for PD-L1–Positive Non–Small-Cell Lung Cancer, N Engl J Med. 2016; 375(19): 1823-33. [Pubmed]
執筆:横浜市立大学附属病院 呼吸器病学教室 久保 創介 先生
監修:静岡県立静岡がんセンター 呼吸器内科 医長 和久田 一茂 先生
監修:静岡県立静岡がんセンター 呼吸器内科 医長 和久田 一茂 先生