| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 非小細胞肺癌 | 一次治療 | 第3相 | PFS, PFS2, OS | 国内 | あり |
試験名 :NEJ009
レジメン:ゲフィチニブ+カルボプラチン+ペメトレキセドvsゲフィチニブ
登録期間:2011年10月〜2014年9月
背景
EGFR遺伝子変異陽性進行非小細胞肺癌 (NSCLC)において、EGFRチロシンキナーゼ阻害薬(EGFR-TKI)単剤治療は良好な治療効果を呈するが、いずれ病勢進行を認めるためさらなる治療成績の向上が必要である。そのための治療戦略として、EGFR-TKIと化学療法の併用が挙げられる。EGFR遺伝子変異陽性NSCLCを対象として、ゲフィチニブ(GEF)単独療法とプラチナ併用化学療法を比較した第3相試験であるNEJ002試験では、GEF単独療法群のおよそ30%の患者が後治療のプラチナ併用化学療法を受けることができず、EGFR-TKIとプラチナ化学療法の併用療法が予後を改善するのではないかと考えられた。EGFR遺伝子変異陽性NSCLCの一次治療において、GEFとプラチナ併用化学療法の同時併用と交替併用療法を比較する無作為化第2相試験であるNEJ005試験が行われ、同時併用療法群は交替併用療法と比較して、良好なOSを示した (41.9か月 vs. 30.7か月、HR 0.51、95%CI 0.26–0.99、P = 0.042)。これらの結果結果をうけて、EGFR-TKI単独治療とEGFR-TKIとプラチナ併用化学療法の同時併用を検証する第3相試験であるNEJ009試験が実施された。
シェーマ
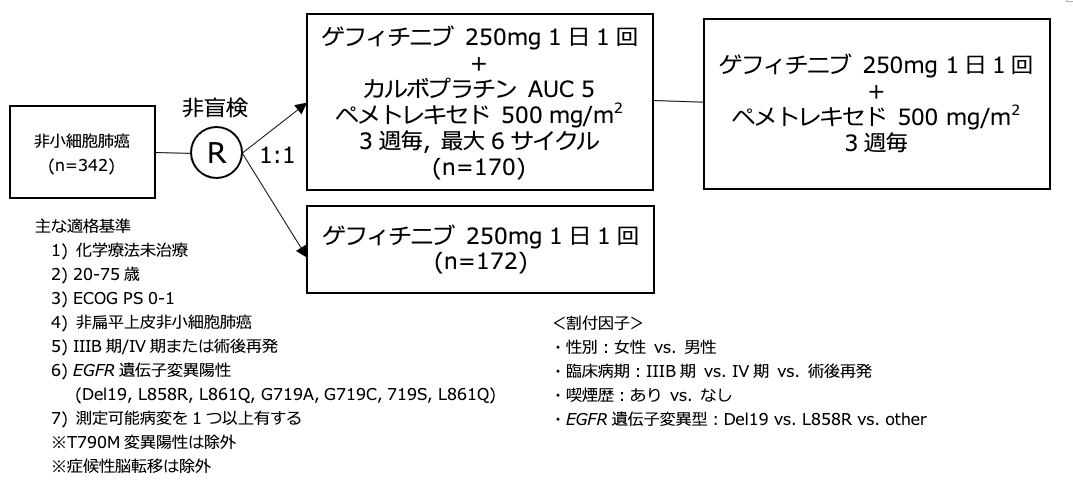
統計学的事項
主要評価項目:無増悪生存期間 (PFS), PFS2, OS
PFSは無作為化から初回増悪 (PD)までの期間と定義され、PFS2は無作為化からGEFとプラチナ併用化学療法の両治療法が無効となるまでの期間と定義された。つまり、標準治療群では、GEF治療増悪後に、推奨されたカルボプラチン(CBDCA)+ペメトレキセド(PEM)による二次治療が増悪するまでの期間である。試験治療群ではPFS2はPFSと同様の期間となる。試験開始時は主要評価項目がOSであったが、試験期間中にオシメルチニブや免疫チェックポイント阻害剤が導入され、後治療によるOSへの影響が懸念された。そのためプロトコール改訂が行われ、主要評価項目はPFS、PFS2、OSに変更となった。
主要評価項目の解析において、複数の項目を段階的に検証する階層別逐次評価法が採用された。第一段階として、試験治療群の標準治療群に対するPFSの優越性を検証し、その優越性が示された場合には、第二段階として試験治療群のPFS2の優越性を検証する。第二段階でも優越性が示されれば、OS の優越性が検証される。
GEF単独療法群では、初回PD後も臨床的有用性を考慮して投与を継続する症例 (beyond PD)が含まれていたため、初回PDから二次治療の開始までの期間 (beyond PD期間)を差し引いた修正PFS2も算出された。
本試験は、NEJ002試験を参考にして、GEF単独療法群のOS中央値が27か月と仮定された。GEFとプラチナ化学療法の併用療法群のGEF単独療法群に対するOSのハザード比 (HR)を0.70と見込んだ場合、αエラー0.05 (両側)において、検出力80%を確保するための必要症例数は両群合計で340例と設定された。PFS、PFS2に対してHR 0.70と仮定した場合、十分な検出力が維持されていることが確認された。
試験結果:
- 2011年10月から2014年9月の間に345例が登録され、GEF群に173例、GEF+CBDCA+PEM群に172例が割り付けされた。Intention-to-treat解析の対象は、GEF群で172例、GEF+CBDCA+PEM群で170例であった。両群間で患者背景に偏りはなかった。
- GEF+CBDCA+PEM群はGEF群より有意にPFSを延長した (20.9ヶ月 vs 11.2ヶ月、HR 0.49、95%信頼区間(CI) 0.39-0.62、P < 0.01)。
- PFS2は両群で有意差はなかった (20.9ヶ月 vs 20.7ヶ月、HR 0.99、95%CI 0.78-1.25、P = 0.90)。
- 修正PFS2はGEF+CBDCA+PEM群がGEF群より延長していた (20.9ヶ月 vs 18.0ヶ月、HR 0.82、95%CI 0.65-1.03、P = 0.09)。
- PFS2において優越性を認めなかったため、OSに関しては探索的な事後解析が実施された。OS中央値はGEF+CBDCA+PEM群が50.9ヶ月、GEF群が38.8ヶ月で (HR 0.72、95%CI 0.55-0.95、P = 0.02)、GEF+CBDCA+PEM群がGEF群より良好な結果であった。
- Grade 3以上の有害事象の頻度はGEF+CBDCA+PEM群で65.3%、GEF群で31%であった。発熱性好中球減少はGEF群では認めなかったが、GEF+CBDCA+PEM群では3%の頻度で認められた。治療関連死はGEF+CBDCA+PEM群で1例に認め、重症感染症が原因であった。
- Quality of life (QOL)は治療前、治療後ともにスコアに差は認めず、化学療法の追加によって、QOLは下がらなかった。
1. 無増悪生存期間(主要評価項目)
| 中央値 | 95%信頼区間 | HR 0.49 (0.39-0.62) P < 0.001 |
|
| GEF+CBDCA+PEM群 | 20.9ヶ月 | 17.9-24.2 | |
| GEF群 | 11.2ヶ月 | 9.0-13.4 |
2. 無増悪生存期間2(主要評価項目)
| 中央値 | 95%信頼区間 | HR 0.99 (0.78-1.25) P = 0.90 |
|
| GEF+CBDCA+PEM群 | 20.9ヶ月 | 18.0-24.0 | |
| GEF群 | 20.7ヶ月 | 17.9-24.9 |
3. 修正無増悪生存期間2(主要評価項目)
| 中央値 | 95%信頼区間 | HR 0.82 (0.65-1.03) P = 0.09 |
|
| GEF+CBDCA+PEM群 | 20.9ヶ月 | 18.0-24.0 | |
| GEF群 | 18.0ヶ月 | 15.7-21.2 |
4. 全生存期間(主要評価項目)
| 中央値 | 95%信頼区間 | HR 0.72 (0.55-0.95) P = 0.02 |
|
| GEF+CBDCA+PEM群 | 50.9ヶ月 | 41.8-62.5 | |
| GEF群 | 38.8ヶ月 | 31.1-47.3 |
5. 奏効割合
| 奏効割合 | 95%信頼区間 | P < 0.001 | |
| GEF+CBDCA+PEM群 | 84% | 79-90 | |
| GEF群 | 67% | 60-74 |
6. 有害事象
| GEF+CBDCA+PEM群 (N=170) | GEF群 (N=171) | |||
|---|---|---|---|---|
| All grades | Grade≧3 | All grades | Grade≧3 | |
| 好中球減少 | 59% | 31% | 4% | 1% |
| 貧血 | 66% | 21% | 21% | 2% |
| 血小板減少 | 54% | 17% | 5% | 0% |
| 肝機能障害 | 61% | 12% | 60% | 22% |
| 皮疹 | 65% | 4% | 81% | 3% |
| 下痢 | 35% | 4% | 37% | 1% |
| 発熱性好中球減少 | 3% | 3% | 0% | 0% |
| 感染 | 13% | 5% | 4% | 0% |
| 肺臓炎 | 7% | 2% | 4% | 1% |
結語
GEF+CBDCA+PEM群はGEF群と比較して有意にPFSを延長した。OSの結果に関しては更なる検証が必要である。
執筆:近畿大学医学部 内科学教室 腫瘍内科部門 助教 加藤 了資 先生
監修:市立岸和田市民病院 腫瘍内科 医長 谷崎 潤子 先生
監修:市立岸和田市民病院 腫瘍内科 医長 谷崎 潤子 先生