| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 膵癌 | 一次治療 | 第3相 | 全生存期間 | 日本・台湾 | あり |
試験名 :GEST
レジメン:GEM+S-1 vs GEM vs S-1
登録期間:2007年7月〜2009年10月
背景
進行膵癌に対してはゲムシタビン(GEM)単剤療法が標準治療であり、様々な第2相試験において有望とされた治療があったが、本試験が行われていた当時、第3相試験においてGEM単剤に優越性を示した治療はGEM+erlotinibのみであり、かつ、その上乗せ効果はわずかなものであった。
第2相試験において、S-1単剤およびGEM+S-1療法(GS)の有効性が示唆されていた。本試験は、全生存期間において、GEM単剤に対する、S-1単剤の非劣性と、GSの優越性を検証するために行われた。
第2相試験において、S-1単剤およびGEM+S-1療法(GS)の有効性が示唆されていた。本試験は、全生存期間において、GEM単剤に対する、S-1単剤の非劣性と、GSの優越性を検証するために行われた。
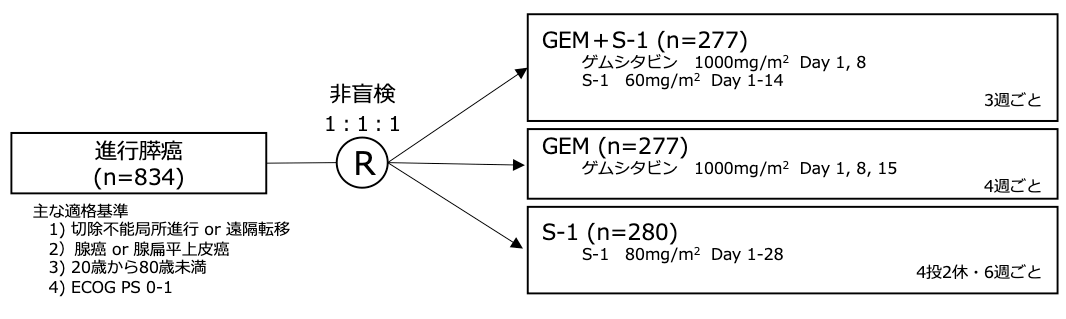
シェーマ
統計学的事項
主要評価項目:全生存期間
本試験はGEM群を対照として、全生存期間において、S-1群の非劣性と、GS群の優越性を検証する3群試験として設計された。生存期間中央値は、GEM群が7.5ヶ月、S-1群が8.0ヶ月、GS群が10.5ヶ月と見積もられた。試験全体の片側α=0.025とし、非劣性・優越性ともにα=0.0125とした。GSの優越性はlog-rank testで検定され、S-1の非劣性はCoxハザードモデルで両側97.5%の信頼区間で検定された。S-1の非劣性マージンは1.33に設定された。
当初の計画では検出力80%、登録期間3年、追跡期間2年として、600例との登録が必要と設定されていた。しかし、症例登録が予定よりも早く進んだため、検出力を90%として750例を目標登録症例数としてプロトコール変更が行われた。最終的に680イベントが発生した後に最終解析が行われた。
試験結果:
- 2007年7月から2009年10月、日本、台湾の75施設で834例が登録された。
- 2例は登録後同意撤回があり、832例に対し、解析が行われた。
- データカットオフは、2010年7月であり、観察期間中央値は、18.4ヶ月であった。
- 患者背景に大きな隔たりはなかったが、PS1はGS群にやや多く、CA19-9はGEM群で高値であった。
1. 全生存期間(主要評価項目)
| 中央値 | 95%信頼区間 |  |
|
| GEM+S-1(n=277) | 10.1ヶ月 | 9.0-11.2 | |
| GEM(n=277) | 8.8ヶ月 | 8.0-9.7 | |
| S-1(n=280) | 9.7ヶ月 | 7.6-10.8 |
2. 無増悪生存期間
| 中央値 | 95%信頼区間 |  |
|
| GEM+S-1(n=277) | 5.7ヶ月 | 5.4-6.7 | |
| GEM(n=277) | 4.1ヶ月 | 3.0-4.4 | |
| S-1(n=280) | 3.8ヶ月 | 2.9-4.2 |
3. 奏効割合
| 奏効割合 | 95%信頼区間 | 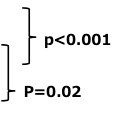 |
|
| GEM+S-1(n=277) | 29.3% | 23.7-35.5 | |
| GEM(n=277) | 13.3% | 9.3-18.2 | |
| S-1(n=280) | 21.0% | 16.1-26.6 |
4. 病勢制御割合
| 病勢制御割合 | 95%信頼区間 | 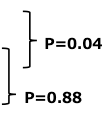 |
|
| GEM+S-1(n=277) | 71.5% | 65.4-77.1 | |
| GEM(n=277) | 62.7% | 56.2-68.8 | |
| S-1(n=280) | 63.3% | 57.0-69.3 |
5. 有害事象(CTCAE ver.3.0)
| GEM (n=273) | S-1 (n=272) | GS (n=267) | |
|---|---|---|---|
| Grade 3以上 | Grade 3以上 | Grade 3以上 | |
| 好中球数減少 | 51 (18.7%) | 10 (3.7%) | 101 (37.8%) |
| 白血球減少 | 112 (41.0%) | 24 (8.8%) | 166 (62.2%) |
| 血小板数減少 | 30 (11.0%) | 4 (1.5%) | 46 (17.2%) |
| 貧血 | 39 (14.3%) | 26 (9.6%) | 46 (17.2%) |
| 疲労 | 10 (3.7%) | 18 (6.6%) | 13 (4.9%) |
| 皮疹 | 2 (0.7%) | 2 (0.7%) | 11 (4.1%) |
| 食欲不振 | 20 (7.3%) | 31 (11.4%) | 25 (9.4%) |
| 下痢 | 3 (1.1%) | 15 (5.5%) | 12 (4.5%) |
| 口内炎 | 0 (0.0%) | 2 (0.7%) | 6 (2.2%) |
| 嘔気 | 5 (1.8%) | 5 (1.8%) | 12 (4.5%) |
| 嘔吐 | 2 (0.7%) | 4 (1.5%) | 12 (4.5%) |
| 発熱性好中球減少 | 1 (0.4%) | 1 (0.4%) | 5 (1.9%) |
| 肺臓炎 | 5 (1.8%) | 0 (0.0%) | 2 (0.7%) |
結語
切除不能局所進行もしくは遠隔転移を有する膵癌に対して、全生存期間におけるS-1単剤のGEM単剤に対する非劣性が証明され、忍容性も良好で、経口投与という利便性も認められた。GS療法の優越性は認められなかった。
執筆:北海道大学 特任助教 川本 泰之 先生
監修:神奈川県立がんセンター 消化器内科(肝胆膵) 部長 上野 誠 先生
監修:神奈川県立がんセンター 消化器内科(肝胆膵) 部長 上野 誠 先生