| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 膵癌 | 一次治療 | 第2相 | 全生存期間 | 国内 | あり |
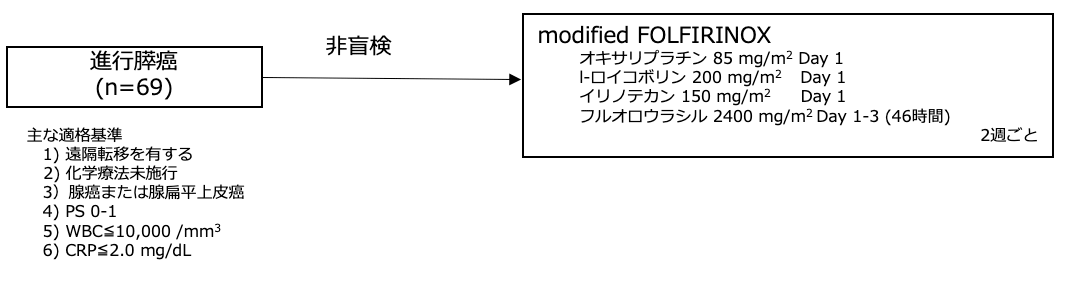
試験名 :なし
レジメン:modified FOLFIRINOX
登録期間:2014年2月〜2014年12月
背景
FOLFIRINOXはPS良好な転移性膵癌の初回治療において、ゲムシタビンとのランダム化比較第3相試験(ACCORD 11試験)の結果を基に標準治療の一つとして認識されている。本邦でも転移性膵癌を対象に第2相試験が実施され、有効性はACCORD 11試験と同等であったことが示された。しかし、Grade 3以上の好中球減少(77.8%)、発熱性好中球減少症(22.2%)の発現頻度が高かった。有効性を保ちつつ、より安全なFOLFIRINOXの開発が必要であると考えられ、最初から5-FU急速静注とイリノテカンを減量して開始する今回の第2相試験の実施に至った。
シェーマ
統計学的事項
主要評価項目:全生存期間
本試験は主要評価項目を全生存期間とした。modified FOLFIRINOX(mFOLFORINOX)の全生存期間の期待値を11ヶ月、閾値を7ヶ月、検出力80%、片側α=0.025として設定し、60例の登録が必要とされた。若干の不適格例を考慮し、予定登録数は65例とした。試験結果:
- 2014年2月から2014年12月の間に、国内39施設より69例が登録された。
1. 全生存期間(主要評価項目)
| OS中央値 | 95%信頼区間 | 1年生存割合 | |
|---|---|---|---|
| mFOLFIRINOX(n=69) | 11.2ヶ月 | 9.0- | 48.1% |
2. 無増悪生存期間
| PFS中央値 | 95%信頼区間 | 1年無増悪生存割合 | |
|---|---|---|---|
| mFOLFIRINOX(n=69) | 5.5ヶ月 | 4.1-6.7 | 21% |
3. 奏効割合
| 奏効割合 | |
|---|---|
| mFOLFIRINOX(n=69) | 26(37.7%) |
4. 病勢制御割合
| 病勢制御割合 | |
|---|---|
| mFOLFIRINOX(n=69) | 54(78.3%) |
5. 有害事象
| mFOLFIRINOX(n=69) | |
|---|---|
| Grade 3以上 | |
| 好中球減少 | 33 (47.8%) |
| 白血球減少 | 20 (29%) |
| 血小板減少 | 2 (2.9%) |
| 貧血 | 3 (4.3%) |
| 発熱性好中球減少 | 6 (8.7%) |
| 食欲不振 | 11 (15.9%) |
| 下痢 | 7 (10.1%) |
| 嘔気 | 6 (8.7%) |
| 胆管炎 | 6 (8.7%) |
| 疲労 | 4 (5.8%) |
| 末梢性感覚ニューロパチー | 4 (5.8%) |
| インフュージョンリアクション | 1(1.4%) |
好中球減少や発熱性好中球減少症でG-CSFを使用された患者は18%であった。
結語
本試験の結果、modified FOLFIRINOXは有効性を保ったまま、予防的pegfilgrastimの投与なしに安全性を改善した。
執筆:杏林大学 腫瘍内科学 助教 岡野 尚弘 先生
監修:神奈川県立がんセンター 消化器内科 肝胆膵 部長 上野 誠 先生
監修:神奈川県立がんセンター 消化器内科 肝胆膵 部長 上野 誠 先生