| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 膵癌 | 一次治療 | 第3相 | 全生存期間 | 国際 | なし |
試験名 :MPACT
レジメン:nab-PTX+GEM vs GEM
登録期間:2009年5月〜2012年4月
背景
1997年以降、切除不能な局所進行または進行再発膵癌に対する一次治療の標準療法は長らくゲムシタビン(GEM)単剤療法であり、様々な第2相試験において有望とされた治療があったが、第3相試験においてGEM単剤に優越性を示した治療はGEM+erlotinibとFOLFIRINOX療法のみであった。
第1/2相試験において、進行膵癌に対するアルブミン懸濁型パクリタキセル(nab-PTX)とGEMの併用療法の有望な有効性が示唆されており、その結果を受けて、転移性膵癌におけるGEM単剤に対するnab-PTX+GEM併用療法の有効性と安全性を検証する国際多施設共同オープンラベル無作為化第3相試験が行われた。
第1/2相試験において、進行膵癌に対するアルブミン懸濁型パクリタキセル(nab-PTX)とGEMの併用療法の有望な有効性が示唆されており、その結果を受けて、転移性膵癌におけるGEM単剤に対するnab-PTX+GEM併用療法の有効性と安全性を検証する国際多施設共同オープンラベル無作為化第3相試験が行われた。
シェーマ
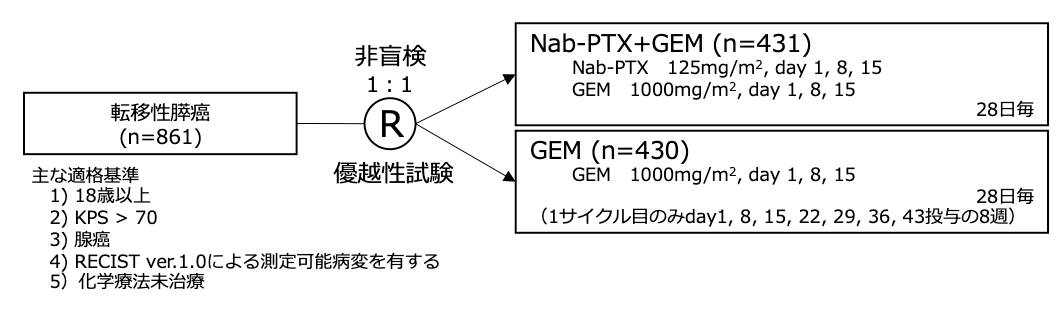
統計学的事項
主要評価項目:全生存期間
本試験はGEM群を対照としてnab-PTX+GEM群の全生存期間のハザード比が0.769となることを検証する優越性試験として設計され、検出力90%(当初は80%)、両側α=0.049として、842例の登録・608イベントが必要と設定された。試験結果:
- 2009年5月から2012年4月まで、11ヵ国、151施設から861例が登録され、431例がnab-PTX+GEM群に、430例がGEM群に割り付けられた。
- データカットオフは、2012年9月17日に行われた。
- 患者背景に大きな隔たりは認めなかった。
1. 全生存期間(主要評価項目)
| 中央値 | 95%信頼区間 | HR 0.72 (95%C.I. 0.62-0.83) P<0.001 |
|
| Nab-PTX+GEM(n=431) | 8.5ヶ月 | 7.89-9.53 | |
| GEM(n=430) | 6.7ヶ月 | 6.01-7.23 |
2. 無増悪生存期間:独立中央判定
| 中央値 | 95%信頼区間 | HR 0.69 (95%C.I. 0.58-0.82) P<0.001 |
|
| Nab-PTX+GEM(n=431) | 5.5ヶ月 | 4.5-5.9 | |
| GEM(n=430) | 3.7ヶ月 | 3.6-4.0 |
3. 奏効割合:独立中央判定
| 奏効割合 | P<0.001 |
|
| Nab-PTX+GEM(n=431) | 23% | |
| GEM(n=430) | 7% |
4. 病勢制御割合:独立中央判定
| 病勢制御割合 | P<0.001 |
|
| Nab-PTX+GEM(n=431) | 48% | |
| GEM(n=430) | 33% |
5. 有害事象 Grade 3以上(NCI-CTCAE ver.3.0)
| Grade 3以上 | ||
|---|---|---|
| Nab-PTX+GEM(n=405) | GEM(n=388) | |
| 好中球数減少 | 153 (38%) | 103 (27%) |
| 白血球減少 | 124 (31%) | 63 (16%) |
| 血小板数減少 | 52 (13%) | 36 (9%) |
| 貧血 | 53 (13%) | 48 (12%) |
| Nab-PTX+GEM(n=421) | GEM(n=402) | |
| 発熱性好中球減少 | 14 (3%) | 6 (1%) |
| 疲労 | 70 (17%) | 27 (7%) |
| 末梢神経障害 | 70 (17%) | 3 (1%) |
| 下痢 | 24 (6%) | 3 (1%) |
結語
転移を有する膵癌に対して、nab-PTX+GEMは全生存期間、無増悪生存期間、奏効割合のいずれにおいてもGEM単剤に対する優越性を示した。有害事象の点では末梢性神経障害と骨髄抑制が増加したが、可逆性と考えられた。
執筆:北海道大学 消化器内科 特任助教 川本 泰之 先生
監修:神奈川県立がんセンター 消化器内科(肝胆膵) 部長 上野 誠 先生
監修:神奈川県立がんセンター 消化器内科(肝胆膵) 部長 上野 誠 先生