| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 膵癌 | 二次治療 | 第3相 | 全生存期間 | 国際 | なし |
試験名 : NAPOLI-1
レジメン: ナノリポソーム化イリノテカン(Nal-IRI)+5-FU/LV vs 5-FU/LV
登録期間: 2012年1月〜2013年9月
背景
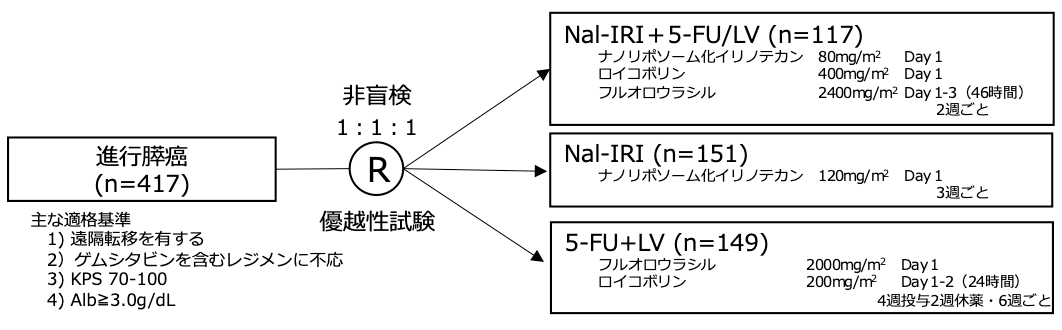
ゲムシタビンを含むレジメンに不応後の進行膵癌に対する標準治療は確立しておらず、5-FU/LVがみなし標準として用いられてきた。Nal-IRI単剤療法が第2相試験で有望な治療成績であったため、5-FU/LVとのランダム化第3相試験が行われた。
シェーマ
統計学的事項
主要評価項目:全生存期間
本試験は5-FU/LV群を対照としてNal-IRI+5-FU/LV群の全生存期間のハザード比が0.5、Nal-IRI群のハザード比が0.67となることを検証する優越性試験として設計され、前者の検出力98%、後者の検出力85%、両側α=0.05として、405例の登録・305イベントが必要と設定された。試験結果:
- 2012年1月から2013年9月に、14ヵ国76施設から417例が登録された。
- 全例がITT解析の対象とされたが、プロトコールver.1はNal-IRI単剤群と5-FU/LV群の比較として行われ、プロトコールver.2で、3群比較として行われた。
- Nal-IRI+5-FU/LV群と5FU/LV群の比較は、プロトコールver.2における117例/119例に対して行われた。
- 2014年2月14日のデータカットオフの段階で、313例の死亡を認めた。
- 患者背景に大きな隔たりはなかったが、KPS不良例は、やや5-FU/LV群に多い傾向にあった。
1. 全生存期間(主要評価項目):Nal-IRI単剤群は5-FU/LV群と有意差認めず、Nal-IRI単剤群は以下割愛
| 中央値 | 95%信頼区間 | HR 0.67 (95%C.I. 0.49-0.92) p=0.012 |
|
| Nal-IRI+5-FU/LV | 6.1ヶ月 | 4.8-8.9 | |
| 5-FU/LV | 4.2ヶ月 | 3.3-5.3 |
2. 無増悪生存期間
| 中央値 | 95%信頼区間 | HR 0.56 (95%C.I. 0.41-0.75) p=0.0001 |
|
| Nal-IRI+5-FU/LV | 3.1ヶ月 | 2.7-4.2 | |
| 5-FU/LV | 1.5ヶ月 | 1.4-1.8 |
3. 奏効割合
| 奏効割合 | 奏効割合の差 15.4% (95%C.I. 8.5-22.3) p<0.0001 |
|
| Nal-IRI+5-FU/LV | 16.2% | |
| 5-FU/LV | 0.8% |
4. 有害事象
| Nal-IRI+5-FU/LV | 5-FU/LV | |||
|---|---|---|---|---|
| 全Grade | Grade 3以上 | 全Grade | Grade 3以上 | |
| 下痢 | 69 (59%) | 15 (13%) | 35 (26%) | 6 (4%) |
| 嘔吐 | 61 (52%) | 13 (11%) | 35 (26%) | 4 (3%) |
| 吐気 | 60 (51%) | 9 (8%) | 46 (34%) | 4 (3%) |
| 食欲不振 | 52 (44%) | 5 (4%) | 43 (32%) | 3 (2%) |
| 疲労 | 47 (40%) | 16 (14%) | 37 (28%) | 5 (4%) |
| 好中球減少 | 46 (39%) | 32 (27%) | 7 (5%) | 2 (1%) |
| 貧血 | 44 (38%) | 11 (9%) | 31 (23%) | 9 (7%) |
結語
本試験の結果、Nal-IRI+5-FU/LVはゲムシタビン含有レジメンに不応の進行膵癌に対する二次化学療法として、5-FU+LVに対する全生存期間の優越性を示した。Nal-IRI+5-FU/LVの有害事象は対処可能であり、可逆的であった。
執筆:神奈川県立がんセンター 消化器内科 肝胆膵 医長 小林 智先生
監修:神奈川県立がんセンター 消化器内科 肝胆膵 医長 上野 誠先生
監修:神奈川県立がんセンター 消化器内科 肝胆膵 医長 上野 誠先生