| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
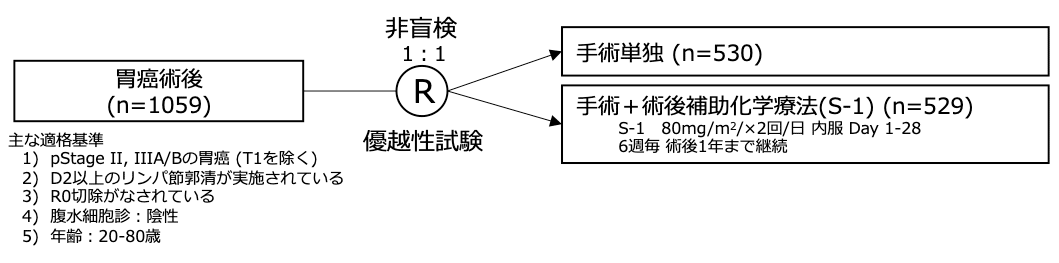
| 胃癌術後 (pStage II/III) |
術後補助化学療法 | 第3相 | 全生存期間 | 国内 | あり |
試験名 :ACTS-GC
レジメン:手術単独 vs 手術+術後補助化学療法(S-1)
登録期間:2001年9月〜2004年12月
背景
本試験の立案当時、胃癌治療における術後補助化学療法の有用性はメタ解析で示されてはいたが、大規模臨床試験での確立はされていなかった。2001年、INT-0116試験の結果より胃癌/食道胃接合部腺癌に対する術後化学放射線療法の有効性が示され、その後、MAGIC試験の結果より周術期化学療法の有効性が示されたが、両試験とも縮小手術後の術後療法の有用性を評価したに過ぎず、手術手技の違いがこれらの結果に影響を与えた可能性も示唆された。一方、本邦における胃切除術は拡大リンパ節郭清(D2)が標準治療として認識されている。
S-1は進行/再発胃癌を対象とした2つの後期第2相試験において40%を越える奏効割合を示した。また、S-1から誘導されるフルオロウラシルの薬物動態は胃切除の影響を受けず、術後補助化学療法に適していると考えられたため、まずは探索試験が行われ、胃切除後の症例に対するS-1の忍容性が確認された。以上の背景より胃癌術後の補助化学療法におけるS-1の有効性と安全性を検証することを目的に本試験が実施された。
S-1は進行/再発胃癌を対象とした2つの後期第2相試験において40%を越える奏効割合を示した。また、S-1から誘導されるフルオロウラシルの薬物動態は胃切除の影響を受けず、術後補助化学療法に適していると考えられたため、まずは探索試験が行われ、胃切除後の症例に対するS-1の忍容性が確認された。以上の背景より胃癌術後の補助化学療法におけるS-1の有効性と安全性を検証することを目的に本試験が実施された。
シェーマ
統計学的事項
主要評価項目:全生存期間
本試験は手術単独群の5年生存割合を70%と仮定し、S-1群の全生存期間のハザード比が0.70となることを検証する優越性試験として設計され、検出力80%、両側α=0.05、登録期間3年、観察期間5年として、1,000例の登録が必要とされた。また、登録完了後、1年と3年で中間解析を実施することが規定された。試験結果:
- 2001年10月から2004年12月までの間に、日本国内109施設より1,059例が登録され、手術単独群に530例、S-1群に529例が無作為割り付けされた。
- 無作為割り付け後、25例(手術単独群 11例/S-1群 14例)が不適格であることが判明した。
腹水細胞診未検(9例)、重複癌(5例)、前治療歴あり(4例)、
臨床検査値異常(4例)、縮小手術(D1)(1例)、Stage IV(1例)、
深達度T1(1例)
主解析は不適格例も含めた全無作為化症例で実施された。 - 2005年12月のデータを元に、2006年6月、最終症例登録後1年の初回中間解析が実施され、全生存期間(全無作為化例 p=0.002, 適格例 p<0.001)・無再発生存期間(全無作為化例 p<0.001, 適格例 p<0.001)のいずれも術後補助化学療法(S-1群)で良好な結果であった。中間解析の早期中止基準はp=0.001と事前設定されており、安全性評価委員会より試験の早期中止が勧告された。
- 本解析結果は2006年6月30日のデータに基づいたものである。
1. 患者背景
- 患者背景、手術手技や病理所見は2群間で概ねバランスがとれていた。
2. 全生存期間 (主要評価項目)
- 観察期間中央値は両群とも2.9年であった。
| イベント数 | 3年生存割合 | 95%信頼区間 | HR 0.68 (95%C.I. 0.52-0.87), p=0.003 | |
|---|---|---|---|---|
| 手術単独群 | 140 | 70.1% | 65.5-74.6 | |
| S-1群 | 102 | 80.1% | 65.5-74.6 |
- 適格例での解析:HR 0.66 (95%信頼区間 0.51-0.86), p=0.002
3. 無再発生存期間
| 3年無再発生存割合 | 95%信頼区間 | HR 0.62 (95%C.I. 0.50-0.77), p<0.001 | |
| 手術単独群 | 59.6% | 54.9-64.3 | |
| S-1群 | 72.2% | 67.9-76.4 |
4. 初回再発部位
| 再発部位 | S-1群 N (%) |
手術単独群 N (%) |
HR(95%C.I.) | P値 |
|---|---|---|---|---|
| 全再発症例 | 133 (25.1) | 188 (35.5) | ||
| 局所 | 7 (1.3) | 15 (2.8) | 0.42 (1.16-1.00) | 0.05 |
| リンパ節 | 27 (5.1) | 46 (8.7) | 0.54 (0.33-0.87) | 0.01 |
| 腹膜 | 59 (11.2) | 84 (15.8) | 0.64 (0.46-0.89) | 0.009 |
| 血行性 | 54 (10.2) | 60 (11.3) | 0.84 (0.58-1.21) | 0.35 |
- 再発は腹膜転移/血行性転移の頻度が高かったが、リンパ節転移と腹膜転移の頻度は、手術単独群に比べてS-1群で低かった。
5. 生存期間に関するサブ解析
- 適格例の全生存期間に関して、性別・年齢・病期(胃癌取り扱い規約+TNM分類)・深達度・リンパ節転移・組織型に関してサブ解析が実施されたが、これら因子と治療との間に有意な交互作用は認めなかった。
6. 有害事象 (NCI-CTC ver.2.0)
| S-1群 (n=517) | 手術単独群 (n=526) | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Grade | 1 | 2 | 3 | 4 | 3-4(%) | 1 | 2 | 3 | 4 | 3-4(%) |
| 白血球減少 | 157 | 144 | 6 | 0 | 1.2 | 93 | 32 | 2 | 0 | 0.4 |
| 貧血 | 293 | 167 | 6 | 0 | 1.2 | 311 | 64 | 3 | 1 | 0.8 |
| 血小板数減少 | 123 | 10 | 1 | 0 | 0.2 | 32 | 2 | 2 | 0 | 0.4 |
| AST増加 | 193 | 30 | 9 | 0 | 1.7 | 177 | 30 | 17 | 1 | 3.4 |
| ALT増加 | 192 | 26 | 6 | 0 | 1.2 | 182 | 27 | 16 | 1 | 3.2 |
| 血中ビリルビン増加 | 155 | 75 | 7 | 1 | 1.5 | 40 | 13 | 5 | 1 | 1.1 |
| 口腔粘膜炎 | 139 | 26 | 1 | 0 | 0.2 | 16 | 2 | 0 | 0 | 0.0 |
| 食欲不振 | 213 | 72 | 30 | 1 | 6.0 | 63 | 9 | 8 | 3 | 2.1 |
| 悪心 | 146 | 37 | 19 | - | 3.7 | 40 | 7 | 6 | - | 1.1 |
| 嘔吐 | 88 | 23 | 6 | 0 | 1.2 | 42 | 6 | 7 | 3 | 1.9 |
| 下痢 | 227 | 66 | 16 | 0 | 3.1 | 85 | 11 | 1 | 0 | 0.2 |
| 皮疹 | 111 | 52 | 5 | 0 | 1.0 | 6 | 4 | 2 | 0 | 0.4 |
| 疲労 | 242 | 60 | 3 | 0 | 0.6 | 88 | 4 | 3 | 0 | 0.6 |
- S-1群で実際の投与を受けなかった12例、手術単独群で無作為割り付け後に治療の変更を希望した4例が安全性解析から除外された。
7. 投与状況
- 実際にS-1の投与を受けた517例中、少なくとも3ヶ月のS-1投与を継続できた症例は452例(87.4%)、6ヶ月継続 403例(77.9%)、9ヶ月継続 366例(70.8%)、12ヶ月継続 340例(65.8%)であった。
- S-1の中止理由としては、有害事象やその他の原因での患者拒否 71例、有害事象や合併症などが原因による医師判断 72例、転移/再発の発見 25例、胃癌以外の癌の発症 2例、登録後の不適格 5例、他院への転院 2例であった。
- S-1の減量は、219例(42.4%)に実施された。S-1内服を12ヶ月間継続できた340例中、158例(46.5%)でS-1が減量されていた。
結語
局所進行胃癌に対して外科的切除(D2郭清)が施行された東アジア人患者に対して、S-1単剤療法は術後補助化学療法として有効である。
執筆:独立行政法人国立病院機構 大阪医療センター 消化器内科 医師 長谷川 裕子 先生
監修:北海道大学病院 消化器内科 助教 結城 敏志 先生
監修:北海道大学病院 消化器内科 助教 結城 敏志 先生