| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 胃癌術後 (pStage III) |
術後補助化学療法 | 第3相 | 3年無再発生存割合 | 国内 | あり |
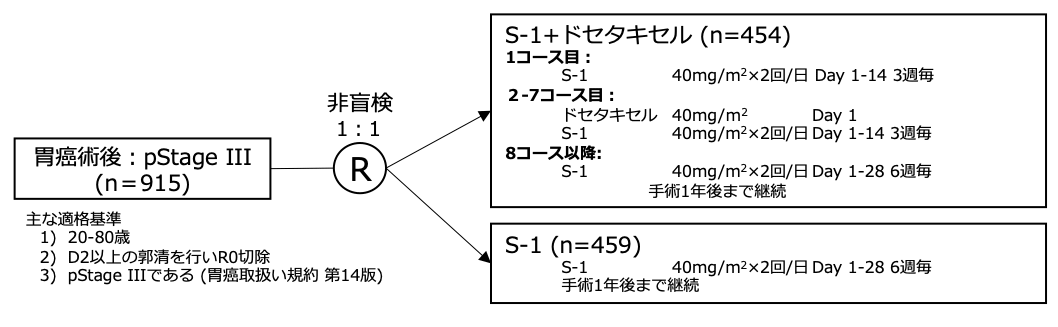
試験名 :JACCRO GC-07
レジメン:S-1 vs S-1+ドセタキセル
登録期間:2013年4月〜2017年4月
背景
アジアにおいて、胃がんは切除可能例が多いことと、D2郭清により良好な局所コントロールが得られることから、補助治療として術後補助化学療法に焦点が当てられてきた。
2007年に報告されたACTS-GC試験では、pStage II/IIIの術後胃がん症例を対象として、手術単独療法と比較し、術後12ヶ月間のS-1単剤療法が全生存期間と無再発生存期間を有意に延長した。更に、韓国を中心として行われたCLASSIC試験においても、手術単独療法と比較し、術後6ヶ月間のカペシタビン+オキサリプラチン併用療法が5年生存割合においてS-1単剤療法と同等の改善を示し、アジアでは2つの標準的術後補助化学療法が存在している。
S-1単剤療法に関しては、pStage III症例において有効性が低下し、血行性転移再発を十分に防ぐことができず、更なる改良が必要と考えられてきた。
ドセタキセルは胃がんに対して、単剤のみならず、S-1との併用や5-FU/シスプラチンとの併用で有効性が示されており、術後補助化学療法として、S-1+ドセタキセル併用療法のS-1単剤療法に対する優越性を検証する臨床試験が計画された。
2007年に報告されたACTS-GC試験では、pStage II/IIIの術後胃がん症例を対象として、手術単独療法と比較し、術後12ヶ月間のS-1単剤療法が全生存期間と無再発生存期間を有意に延長した。更に、韓国を中心として行われたCLASSIC試験においても、手術単独療法と比較し、術後6ヶ月間のカペシタビン+オキサリプラチン併用療法が5年生存割合においてS-1単剤療法と同等の改善を示し、アジアでは2つの標準的術後補助化学療法が存在している。
S-1単剤療法に関しては、pStage III症例において有効性が低下し、血行性転移再発を十分に防ぐことができず、更なる改良が必要と考えられてきた。
ドセタキセルは胃がんに対して、単剤のみならず、S-1との併用や5-FU/シスプラチンとの併用で有効性が示されており、術後補助化学療法として、S-1+ドセタキセル併用療法のS-1単剤療法に対する優越性を検証する臨床試験が計画された。
シェーマ
統計学的事項
主要評価項目:3年無再発生存割合
ACTS-GC試験の結果を基に、S-1群の3年無再発生存割合を62%と設定し、S-1+ドセタキセル群で7%の上乗せがあることを期待した。観察期間 3年、両側α=0.05、検出力 80%で必要症例数を各群 530例と設定した。若干の脱落例を考慮し、各群 550例で計1100例の登録予定とした。
本試験では2回の中間解析が予定された。初回は試験開始後25ヶ月、予定されたイベント数の5分の1に当たる100イベントが生じた時点に行われた。早期試験中止の可否は試験開始後34ヶ月、予定されたイベントの3分の1に当たる170イベントが生じた時点での2回目中間解析で評価された。
試験結果:
- 2013年4月から2017年12月までの間に日本国内138施設から915人が登録された。Stage IV、重複登録の2例が除外され、S-1+ドセタキセル群に454例、S-1群に459例が無作為割付された。
- 安全性解析は登録終了の1年前である2016年4月30日までに登録された705例の内、実際に投与されなかったS-1+ドセタキセル群の10例、S-1群の6例を除いた689例(S-1+ドセタキセル群 341例/S-1群 348例)が解析対象となった。
- 患者背景は両群間でバランスがとれていた。
1. 無再発生存期間/3年無再発生存割合 (主要評価項目)
- 本試験は2017年4月に実施された第2回中間解析(観察期間中央値 12.5ヶ月)において、無再発生存期間と3年無再発生存割合がS-1群に対して、S-1+ドセタキセル群で有意な改善を認め、独立性効果安全性評価委員会より試験の有効中止が推奨され、試験中止となった。
| 3年無再発生存割合 | 95%信頼区間 | 中央値 | 95%信頼区間 | HR 0.632 (99.99%C.I. 0.400-0.998) P<0.001 |
|
| S-1+ドセタキセル | 66% | 59-73 | 未到達 | ー | |
| S-1 | 50% | 41-58 | 34.5ヶ月 | 29.5-未到達 |
- 性別、年齢、病期、深達度、リンパ節因子、組織分類、ECOG PS、術式、原発部位でのサブ解析では治療レジメンとこれら因子の間に交互作用は認めなかった。下記に病期によるサブ解析結果を記載する。
| ハザード比 | 95%信頼区間 | p値(交互作用) | |
|---|---|---|---|
| pStage IIIA pStage IIIB pStage IIIC |
0.524 0.614 0.693 |
0.285-0.966 0.382-0.989 0.466-1.03 |
0.4016 |
2. 全生存期間
- 2017年4月の時点でS-1+ドセタキセル群で44例、S-1群で60例の死亡が生じたが、イベント数が少ないため、全生存期間に有意差は得られなかった(p=0.13)。
3. 投与状況
- S-1・ドセタキセルの投与状況は下記の表の通り
| N (%) | S-1+ドセタキセル (n=341) |
S-1 (n=348) |
|---|---|---|
| S-1 3ヶ月投与 6ヶ月投与 9ヶ月投与 12ヶ月投与 減量 |
303 (89) 262 (77) 226 (66) 168 (49) 132 (39) |
312 (90) 275 (79) 242 (70) 195 (56) 103 (30) |
| ドセタキセル 0サイクル 1サイクル 2サイクル 3サイクル 4サイクル 5サイクル 6サイクル 減量 |
21 (6) 29 (9) 13 (4) 8 (2) 9 (3) 20 (6) 234 (69)* 94 (28) |
- - - - - - - - |
* 論文Figureでは241例(71%)と記載があるが、本文記載の数値を記載
- 投与延期を要した症例はS-1+ドセタキセル群で66%(95%信頼区間 61-71)、S-1群で57%(95%信頼区間 52-62)であった。
- 投与延期は最初の3ヶ月(S-1+ドセタキセル群 46%(95%信頼区間 41-51)/S-1群 31%(95%信頼区間 26-35))と次の3ヶ月(S-1+ドセタキセル群 48%(95%信頼区間 42-54)/S-1群 30%(95%信頼区間 25-35))に多かった。
4. 有害事象 (CTCAE ver.4.0)
- Grade 3以上の有害事象はS-1+ドセタキセル群で198人(58%:95%信頼区間 53-63)、S-1群で147人(42%:95%信頼区間 37-47)に生じた。
- S-1群の1例が呼吸不全で死亡し、治療関連と考えられた。
- 重篤な有害事象によりS-1+ドセタキセル群の47例(食欲不振 n=8、腸閉塞 n=7、発熱性好中球減少 n=5、血栓症 n=4)、S-1群の41例(食欲不振 n=8、下痢 n=7、腸閉塞 n=5、腸炎 n=4)が入院を要した。
| S-1+ドセタキセル(n=341) | S-1(n=348) | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Grade | 1 | 2 | 3 | 4 | 3-4(%) | 1 | 2 | 3 | 4 | 3-4(%) |
| 白血球減少 | 50 | 66 | 67 | 10 | 22.6 | 74 | 77 | 6 | 1 | 2.0 |
| 好中球数減少 | 24 | 46 | 72 | 58 | 38.1 | 38 | 68 | 53 | 3 | 16.1 |
| 血小板数減少 | 59 | 3 | 3 | 1 | 1.2 | 57 | 16 | 1 | 0 | 0.3 |
| 貧血 | 69 | 66 | 15 | 0 | 4.4 | 67 | 79 | 8 | 0 | 2.3 |
| 血中ビリルビン増加 | 42 | 28 | 2 | 0 | 0.6 | 72 | 35 | 5 | 0 | 1.4 |
| 食欲不振 | 109 | 59 | 48 | 0 | 14.1 | 94 | 47 | 43 | 0 | 12.4 |
| 悪心 | 88 | 31 | 14 | 0 | 4.1 | 69 | 36 | 5 | 0 | 1.4 |
| 下痢 | 122 | 36 | 12 | 0 | 3.5 | 95 | 37 | 31 | 0 | 8.9 |
| 口腔粘膜炎 | 93 | 29 | 15 | 0 | 4.4 | 61 | 14 | 7 | 0 | 2.0 |
| 脱毛 | 117 | 80 | - | - | - | 12 | 0 | - | - | - |
| 発熱性好中球減少 | - | - | 15 | 1 | 4.7 | - | - | 1 | 0 | 0.3 |
5. 初回再発部位
| %(95%信頼区間) | S-1+ドセタキセル | S-1 | p |
|---|---|---|---|
| 血行性転移 | 5.3 (3.2-7.3) | 9.8 (7.2-12.7) | 0.012 |
| リンパ節転移 | 4.8 (2.8-6.7) | 11.3 (8.5-14.4) | <0.001 |
| 局所再発 | 0.4 (0-1) | 0.4 (0-0.9) | 1.0 |
| 腹膜播種 | 9.3 (6.5-11.8) | 12.9 (9.9-16.1) | 0.092 |
結語
pStage III胃がんに対する術後補助化学療法として、S-1+ドセタキセル併用療法は安全性への懸念がなく、有効であり、Stage III胃がんに対する標準的な術後補助化学療法として推奨される。
執筆:神戸市立医療センター中央市民病院 腫瘍内科 医長 松本 俊彦 先生
監修:北海道大学病院 消化器内科 助教 結城 敏志 先生
監修:北海道大学病院 消化器内科 助教 結城 敏志 先生