| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 胃癌 | 一次治療 | 第3相 | 無増悪生存期間 | 国際 | なし |
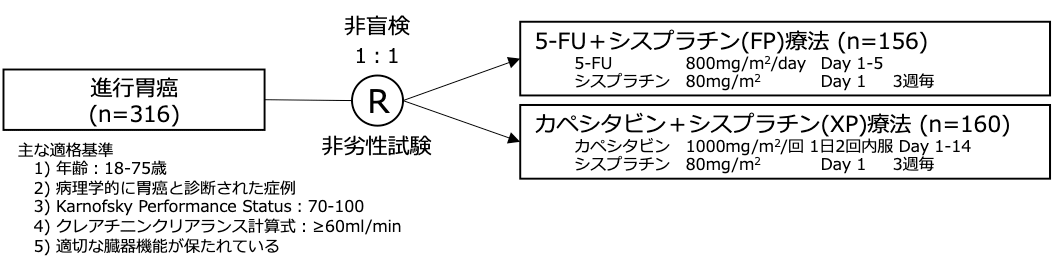
試験名 :ML17032
レジメン:カペシタビン+シスプラチン(XP) vs 5-FU+シスプラチン(FP)
登録期間:2003年4月〜2005年1月
背景
進行胃癌患者に対して、併用化学療法が患者の予後を改善することが広く認識されているが、本試験の計画当時、世界標準として認識されているレジメンは存在しなかった。5-FU+シスプラチン併用療法(FP)は有意な生存延長は示していないが、5-FU単剤療法や他の併用療法と比較して奏効割合、無増悪生存期間に関しては有用性が示されている。これらの結果より韓国や他の多くの国ではFP療法が標準治療として受け入れられていた。
欧州では3剤併用療法が広く検討されており、英国と欧州の一部ではエピルビシン+シスプラチン+5-FU併用療法(ECF療法)が標準治療として受け入れられている。3剤併用療法はメタ解析によって更なる支持を受けているが、このメタ解析はわずか3試験に基づいており、否定的とされている。V325試験はFP療法にドセタキセルを併用することで有意な生存期間の延長を示したが、臨床的なメリットが小さく、血液毒性も高頻度で生じるため、FP療法は施行胃癌に対する標準的治療オプションとして受け入れられてきた。
カペシタビンは5-FU持続静注を代替えすることを目的にデザインされた経口フッ化ピリミジン製剤である。進行胃癌症例に対する第2相試験において、単剤では19~34%、シスプラチンとの併用では55%の奏効割合を報告した。シスプラチンとの併用に際して、5-FUをカペシタビンに置き換えることで持続静注の必要がなくなり、重複する有害事象のほぼない薬剤の組み合わせとなる。REAL-2試験では3剤併用療法を行う際には5-FUをカペシタビンに置き換え可能であることを示した。
この第3相試験は進行胃がんに対する一次治療において、FP療法とカペシタビン+シスプラチン併用療法(XP)の有効性/安全性を比較検討するために実施された。
欧州では3剤併用療法が広く検討されており、英国と欧州の一部ではエピルビシン+シスプラチン+5-FU併用療法(ECF療法)が標準治療として受け入れられている。3剤併用療法はメタ解析によって更なる支持を受けているが、このメタ解析はわずか3試験に基づいており、否定的とされている。V325試験はFP療法にドセタキセルを併用することで有意な生存期間の延長を示したが、臨床的なメリットが小さく、血液毒性も高頻度で生じるため、FP療法は施行胃癌に対する標準的治療オプションとして受け入れられてきた。
カペシタビンは5-FU持続静注を代替えすることを目的にデザインされた経口フッ化ピリミジン製剤である。進行胃癌症例に対する第2相試験において、単剤では19~34%、シスプラチンとの併用では55%の奏効割合を報告した。シスプラチンとの併用に際して、5-FUをカペシタビンに置き換えることで持続静注の必要がなくなり、重複する有害事象のほぼない薬剤の組み合わせとなる。REAL-2試験では3剤併用療法を行う際には5-FUをカペシタビンに置き換え可能であることを示した。
この第3相試験は進行胃がんに対する一次治療において、FP療法とカペシタビン+シスプラチン併用療法(XP)の有効性/安全性を比較検討するために実施された。
シェーマ
統計学的事項
主要評価項目:無増悪生存期間
本試験はFP群を対照群として、XP群の無増悪生存期間のハザード比95%信頼区間の上限が非劣性マージン(1.40)を下回ることを検証する非劣性試験として設計された。検出力80%として、各群150例の登録、計220イベントが必要と設定された。Per-protocol集団(以下を除外:①病勢進行/死亡以外の理由で治療期間が6週未満、②最初の6週間で予定投与量の50%未満の投与量、③適格/除外基準違反、④腫瘍量に関する情報が不十分な症例)で非劣性マージン 1.40で非劣性が確認された場合、非劣性マージン 1.25で二次解析を行う事とした。更に非劣性マージン 1.25で非劣性が確認された場合、最終解析としてFP群に対するXP群の優越性を検討する事とした。
試験結果:
1. 患者背景
- 2003年4月から2005年1月までの間に12ヶ国、42施設より316例が登録された。
- 160名がXP群に、156例がFP群に無作為割り付けされた。
- 患者背景は両群間でバランスがとれていた。
- 40例がPer-protocol集団から除外された:
- 【除外理由内訳】:(重複あり)
- 登録時に腫瘍量に関する情報が不十分(n=2)、
- 登録時に指摘された病変のフォローが不十分で無増悪生存期間を算出できない(n=32)
- 適格/除外基準違反(n=11)
- 投与が2サイクル未満(n=16)
- 以上よりPer-protocol集団はXP群 139例、FP群 137例となった。
2. 無増悪生存期間(主要評価項目)
| Per-protocol集団 | n | 中央値 | 95%信頼区間 | Unadjusted HR 0.81 (95%C.I. 0.63-1.04) p<0.001(非劣性マージン 1.25) p=0.0801(優越性) |
| XP群 | 139 | 5.6ヶ月 | 4.9-7.3 | |
| FP群 | 137 | 5.0ヶ月 | 4.2-6.3 |
| ITT(治療企図)集団 | n | 中央値 | 95%信頼区間 | Unadjusted HR 0.80 (95%C.I. 0.63-1.03) p<0.001(非劣性マージン 1.25) |
| XP群 | 160 | 5.6ヶ月 | 4.8-6.9 | |
| FP群 | 156 | 5.0ヶ月 | 3.9-5.7 |
[中央判定]
| Per-protocol集団 | n | 中央値 | 95%信頼区間 | Unadjusted HR 0.90 (95%C.I. 0.69-1.18) p=0.0169(非劣性マージン 1.25) |
| XP群 | 139 | 6.6ヶ月 | 5.4-8.4 | |
| FP群 | 137 | 6.1ヶ月 | 5.0-7.1 |
3. 投与状況
- 投与期間はXP群で長い傾向を示した。
- [ITT集団での完遂割合]
- 6サイクル完遂割合:XP群 45%, FP群 34%
- 8サイクル完遂割合:XP群 20%, FP群 13%
- 投与サイクル数中央値:XP群 5サイクル(範囲 1-16), FP群 5サイクル(範囲 1-15)
- 計画投与量に対する実投与量の比率(≒相対用量強度)中央値:
- XP群 シスプラチン 1.00 (範囲 0.42-1.01)
- カペシタビン 0.99 (範囲 0.14-1.06)
- FP群 シスプラチン 1.00 (範囲 0.50-1.01)
- 5-FU 1.00 (範囲 0.60-1.12)
4. 全生存期間
| Per-protocol集団 | n | 中央値 | 95%信頼区間 | Unadjusted HR 0.85 (95%C.I. 0.64-1.13) p=0.008(非劣性マージン 1.25) p=0.2650(優越性) |
| XP群 | 139 | 10.5ヶ月 | 9.3-11.2 | |
| FP群 | 137 | 9.3ヶ月 | 7.4-10.6 |
| ITT(治療企図)集団 | n | 中央値 | 95%信頼区間 | Unadjusted HR 0.85 (95%C.I. 0.65-1.11) p=0.005(非劣性マージン 1.25) |
| XP群 | 160 | 10.4ヶ月 | 9.1-11.0 | |
| FP群 | 156 | 8.9ヶ月 | 7.3-10.2 |
5. 無増悪生存期間/全生存期間に関するサブ解析
- Per-protocol集団における無増悪生存期間と全生存期間に関してはÅAé桝Oに指定された予後因子のサブグループについてCox回帰分析によるサブ解析が行われたが、両群におけるハザード比の間に有意差はなく(p>0.16)、95%信頼区間は大幅に重なった。
- ハザード比の大部分は1.0未満であり、XP群で良好な傾向を示したが、サブグループの症例数が少なく、95%信頼区間には1.0が含まれていた。
6. 奏効割合
| Per-protocol集団 | n | 奏効割合 | 95%信頼区間 | オッズ比 1.80 (95%信頼区間 1.11-2.94 p=0.020 |
| XP群 | 139 | 46% | 38-55 | |
| FP群 | 137 | 32% | 24-41 |
7. 奏効までの期間
| ITT(治療企図)集団 | n | 中央値 | Unadjusted HR 1.61 (95%C.I. 1.10-2.35) p=0.015 |
| XP群 | 46 | 3.7ヶ月 | |
| FP群 | 32 | 3.8ヶ月 |
8. 奏効期間
| ITT(治療企図)集団 | n | 中央値 | Unadjusted HR 0.88 (95%C.I. 0.56-1.36) p=0.554 |
| XP群 | 46 | 7.6ヶ月 | |
| FP群 | 32 | 6.2ヶ月 |
9. 有害事象 (NCI-CTCAE ver2.0)
| N(%) | XP群 (n=156) | FP群 (n=155) | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Grade | 1 | 2 | 3 | 4 | 1 | 2 | 3 | 4 | |
| 悪心 | 49 (31) | 35 (22) | 3 (2) | - | 44 (28) | 37 (24) | 4 (3) | - | |
| 嘔吐 | 32 (21) | 33 (21) | 10 (6) | 1 (<1) | 31 (20) | 47 (30) | 13 (8) | - | |
| 下痢 | 9 (6) | 14 (9) | 7 (4) | 1 (<1) | 11 (7) | 6 (4) | 6 (4) | 1 (<1) | |
| 口腔粘膜炎 | 11 (7) | 4 (3) | 3 (2) | - | 15 (10) | 16 (10) | 10 (6) | - | |
| 好中球数減少 | 2 (1) | 24 (15) | 22 (14) | 3 (2) | 2 (1) | 15 (10) | 23 (15) | 6 (4) | |
| 白血球減少 | 3 (2) | 15 (10) | 4 (3) | - | 4 (3) | 16 (10) | 4 (3) | 2 (1) | |
| 食欲不振 | 23 (15) | 18 (12) | 3 (2) | - | 23 (15) | 19 (12) | 1 (<1) | - | |
| 疲労 | 15 (10) | 8 (5) | 1 (<1) | - | 11 (7) | 3 (2) | 1 (<1) | - | |
| 無力症 | 10 (6) | 9 (6) | 3 (2) | - | 14 (9) | 12 (8) | 1 (<1) | - | |
| 手足の皮膚反応 | 20 (13) | 8 (5) | 6 (4) | - | 5 (3) | 1 (<1) | - | - | |
- 概ね、有害事象の発現頻度は両群で近似していた。
- 手足の皮膚反応はXP群で高率であったが(XP:34例[22%] vs FP:6例[4%])、治療中止に至ったのは1例のみであった。
- 一方、嘔吐と口腔粘膜炎はFP群で高率であった(嘔吐:XP:76例[49%] vs FP:91例[59%]、口腔粘膜炎:XP:18例[12%] vs FP:41例[26%])。
- 血液学的有害事象は貧血(XP:27例[17%] vs FP:12例[8%])を除いて、両群で近似していた。
【治療変更・治療中止】
- 有害事象により治療変更(中断/延期/減量)を要した症例:XP群 62%、FP群 48%
- 治療変更を要する有害事象は両群ともに好中球数減少が最多で、ともに37人[24%]であった。
- 治療変更を要する有害事象でFP群よりもXP群で高頻度であった事象は貧血(6% vs 1%)、嘔吐(8% vs 1%)、悪心(6% vs <1%)、下痢(7% vs 2%)、手足の皮膚反応(8% vs 0%)であった。
- 治療中止に至った有害事象は各群28例に生じており、消化器毒性(XP:11例[7%] vs FP:6例[4%])、血液毒性(XP:6例[4%] vs FP:7例[5%])が高頻度であった。
【死亡】
- 治療開始60日以内の死亡はXP群 8例(5%)、FP群 5例(3%)で生じ、XP群の1例、FP群の2例は担当医によって治療関連死亡と判断された。
- 治療中〜最終投与後28日以内の全死亡割合はXP群 9%、FP群 6%であった。これらの内、XP群の5例、FP群の3例は原病増悪以外の死亡であった。
結語
本試験にてXP療法は進行胃癌に対する一次化学療法としてFP療法に対する非劣性を示した。カペシタビンには持続静注に伴う不便さや合併症を回避できるという利点があり、XP療法はFP療法の有効な代替手段と見なすことができ、進行胃癌に対する新しい標準的治療オプションとなり得る。
執筆:香川大学医学部附属病院 腫瘍内科 助教 大北 仁裕 先生
監修:北海道大学病院 消化器内科 助教 結城 敏志 先生
監修:北海道大学病院 消化器内科 助教 結城 敏志 先生