| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 胃癌 | 一次治療 | 第3相 | 全生存期間 | 国内 | あり |
試験名 :SPIRITS
レジメン:S-1 vs S-1+シスプラチン
登録期間:2002年3月〜2004年11月
背景
本邦で行われた進行胃がんを対象としたS-1の第II相試験では44-54%の奏効割合を報告し、S-1は広く一次治療で使用されている。また、シスプラチンは進行胃がんの治療に際して、重要な化学療法薬剤である。
筆者らは進行胃がんに対してS-1+シスプラチン併用療法の第I/II相試験を実施し、良好な有効性(奏効割合 76%・生存期間中央値 383日)と忍容可能な安全性を得た。
以上より、本試験は、進行胃がんに対する一次治療として、S-1+シスプラチン併用療法のS-1単剤に対する全生存期間の優越性を検証するために行われた。
筆者らは進行胃がんに対してS-1+シスプラチン併用療法の第I/II相試験を実施し、良好な有効性(奏効割合 76%・生存期間中央値 383日)と忍容可能な安全性を得た。
以上より、本試験は、進行胃がんに対する一次治療として、S-1+シスプラチン併用療法のS-1単剤に対する全生存期間の優越性を検証するために行われた。
シェーマ
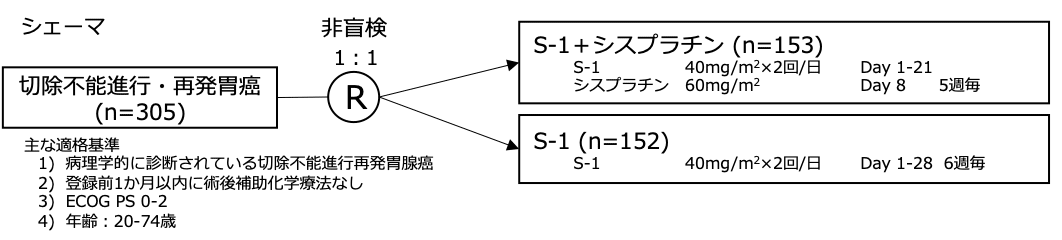
統計学的事項
主要評価項目:全生存期間
本試験は過去の試験結果よりS-1+シスプラチン群の生存期間中央値を12ヶ月、S-1単剤療法の生存期間中央値を8ヶ月と推定した。よって、本試験はS-1を対照群としてS-1+シスプラチンの全生存期間のハザード比が0.67となることを検証する優越性試験として設計され、検出力90%、両側α=0.05として、284人の登録・254のイベントが必要と設定された。若干の不適格例を考慮し、目標登録症例数は300例と設定された。試験結果:
- 2002年3月〜2004年11月の間に日本国内38施設より305例が登録され、S-1+シスプラチン群に153例、S-1群に152例が割り付けられた。
- S-1+シスプラチン群の内、4例は適格基準を満たさず、1例は同意撤回により試験治療を受けなかったため、148例を解析対象とした。S-1群では2例は適格基準を満たさず、150例が解析対象とされた。
- 本解析は最終症例登録後、24ヶ月の時点で行われ、観察期間中央値は34.7ヶ月であった。この解析時点で追跡不能例はいなかった。
1. 患者背景
- 患者背景は両群間でバランスがとれていた。
- S-1+シスプラチン群の87例(59%)、S-1群の106例(71%)は測定可能病変を有していた。
- S-1+シスプラチン群の51例(34%)、S-1群の36例(24%)は腹膜転移を有していた。
- 組織診断はS-1+シスプラチン群の103例(70%)、S-1群の89例(59%)がびまん型(Diffuse type) 、S-1+シスプラチン群の45例(30%)、S-1群の60例(40%)が腸型(Intestinal type)であった。
- 局所進行症例は登録されなかった。
2. 全生存期間 (主要評価項目)
| 中央値 | 四分位範囲 | 12ヶ月生存割合 (95%信頼区間) |
24ヶ月生存割合 (95%信頼区間) |
HR 0.77 (95%C.I. 0.61-0.98) p=0.04 |
|
| S-1+シスプラチン | 13.0ヶ月 | 7.6-21.9 | 54.1% (46.1-62.1) |
23.6% (16.8-30.4) |
|
| S-1 | 11.0ヶ月 | 5.6-19.8 | 46.7% (38.7-54.7) |
15.3% (9.5-21.1) |
3. 無増悪生存期間
| 中央値 | 四分位範囲 | HR 0.57 (95%C.I. 0.44-0.73) p<0.0001 |
|
| S-1+シスプラチン | 6.0ヶ月 | 3.3-12.9 | |
| S-1 | 4.0ヶ月 | 2.1-6.8 |
4. 奏効割合
| 症例数 | 奏効割合 | p=0.002 | |
| S-1+シスプラチン | 87 | 54% | |
| S-1 | 106 | 31% |
5. 有害事象 (NCI-CTC ver.2.0)
| N (%) | S-1+シスプラチン | S-1 | ||
|---|---|---|---|---|
| 全Grade | Grade 3-4 | 全Grade | Grade 3-4 | |
| 白血球減少 | 104 (70) | 17 (11) | 57 (38) | 3 (2) |
| 好中球数減少 | 110 (74) | 59 (40) | 63 (42) | 16 (11) |
| 貧血 | 100 (68) | 38 (26) | 49 (33) | 6 (4) |
| 血小板数減少 | 72 (49) | 8 (5) | 27 (18) | 0 (0) |
| 発熱性好中球減少症 | 5 (3) | 5 (3) | 2 (1) | 2 (1) |
| 食欲不振 | 107 (72) | 45 (30) | 55 (37) | 9 (6) |
| 悪心 | 99 (67) | 17 (11) | 39 (26) | 2 (1) |
| 疲労 | 84 (57) | 6 (4) | 49 (33) | 2 (1) |
| 嘔吐 | 54 (36) | 6 (4) | 21 (14) | 3 (2) |
| 下痢 | 51 (34) | 6 (4) | 34 (23) | 5 (3) |
| クレアチニン増加 | 32 (22) | 0 (0) | 3 (2) | 0 (0) |
| 低ナトリウム血症 | 13 (9) | 4 (3) | 1 (0.7) | 0 (0) |
| 末梢性感覚ニューロパチー | 6 (4) | 0 (0) | 1 (0.7) | 0 (0) |
- 両群ともに治療関連死亡は認めなかった。
- S-1+シスプラチン群の10例(7%)、S-1群の14例(9%)が登録後90日以内に死亡した。S-1+シスプラチン群の5例(3%)、S-1群の14例(9%)が治療終了後30日以内に死亡した。
- S-1+シスプラチン群の21例(14%)、S-1群の18例(12%)が有害事象により、入院加療を要した(統計学的有意差なし)。
6. 投与状況
- S-1+シスプラチン群:総投与サイクル数 588、投与サイクル中央値(範囲) 4(1-11)
- S-1群:総投与サイクル数 520、投与サイクル中央値(範囲) 3(1-12)
- S-1+シスプラチン群の総投与サイクルの内、9.8%は主に骨髄抑制などの有害事象によりシスプラチンが投与されなかった。
- 少なくとも1週以上の投与延期をS-1+シスプラチン群 21例(14%)、S-1群 7例(5%)で要した。
7. 相対用量強度
| 中央値 | |
|---|---|
| S-1+シスプラチン | 93.3% |
| S-1 | 98.0% |
8. 治療中止理由
| N (%) | S-1+シスプラチン | S-1 |
|---|---|---|
| 病勢進行 | 65 (44) | 113 (75) |
| 骨髄抑制・その他の有害事象 | 41 (28) | 25 (17) |
| 同意撤回 | 13 (9) | 6 (4) |
| 手術適応 | 7 (5) | 1 (0.7) |
9. 二次化学療法
| N (%) | S-1+シスプラチン | S-1 |
|---|---|---|
| 二次化学療法施行 | 65 (44) | 113 (75) |
| タキサン系 | 75 (41) | 60 (40) |
| イリノテカン | 21 (14) | 22 (15) |
| シスプラチン | - | 14 (9) |
10. 生存期間に関する探索的サブグループ解析
| 症例数 | ハザード比 | 95%信頼区間 | p値(交互作用) | ||
|---|---|---|---|---|---|
| 腹膜転移 | なし あり |
211 87 |
1.00 0.52 |
0.75-1.33 0.33-0.82 |
0.02 |
| 測定可能病変 | なし あり |
105 193 |
0.54 1.10 |
0.35-0.83 0.82-1.47 |
0.01 |
結語
本試験の結果、S-1+シスプラチン併用療法が進行胃がんに対する標準的一次化学療法となりうると考えられた。
執筆:九州大学大学院 消化器・総合外科 助教 中島 雄一郎 先生
監修:北海道大学病院 消化器内科 助教 結城 敏志 先生
監修:北海道大学病院 消化器内科 助教 結城 敏志 先生