Phase II study evaluating trifluridine/tipiracil + bevacizumab and capecitabine + bevacizumab in first-line unresectable metastatic colorectal cancer (mCRC) patients who are noneligible for intensive therapy (TASCO1): Results of the final analysis on the overall survival.
First Author : Van Cutsem E, et al.
強力な治療に不適な切除不能転移性大腸癌患者に対する一次治療としてのFTD/TPI+ベバシズマブ併用療法とカペシタビン+ベバシズマブ併用療法の第2相試験(TASCO1):全生存期間の最終解析
背景
TASCO1試験1)は強力な治療に不適な切除不能大腸癌患者に対する一次治療として、FTD/TPI+ベバシズマブ併用療法とカペシタビン+ベバシズマブ併用療法の有効性と安全性を検討するランダム化第2相試験である。本試験の結果は既に論文化されており、FTD/TPI+ベバシズマブ併用療法が治療選択肢として有望であることが示された。本報告では全生存期間の最終解析結果が報告された。
対象と方法
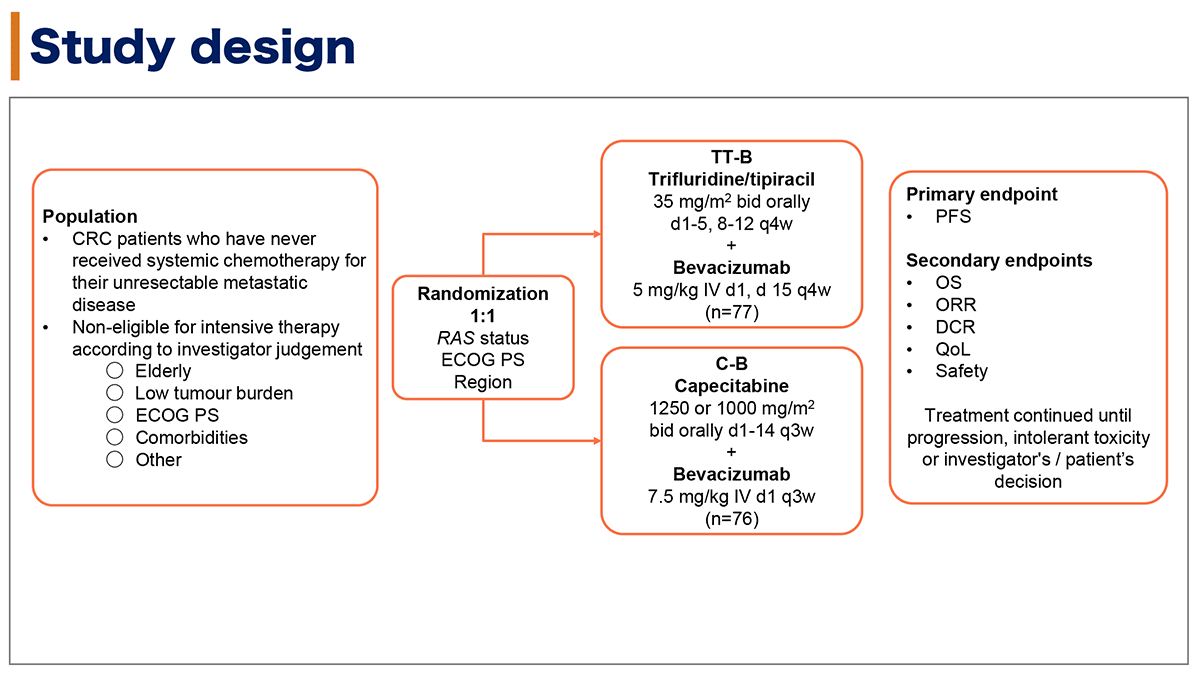
本試験の対象は全身化学療法未施行の切除不能転移性大腸癌症例で、高齢、低腫瘍量、PS不良、合併症等の理由から主治医が強力な治療が不適と判断した症例とされた。RAS遺伝子変異状況、ECOG PS、地域を層別化因子とし、FTD/TPI+ベバシズマブ併用療法群(TT-B群, FTD/TPI 35mg/m2 1日2回, 1-5日・8-12日、ベバシズマブ 5mg/kg 1日目・15日目;4週毎)とカペシタビン+ベバシズマブ併用療法群(C-B群, カペシタビン 1250 or 1000mg/m2 1日2回, 1-14日、ベバシズマブ 7.5mg/kg 1日目;3週毎)に1:1に無作為割り付けされた。
主要評価項目は無増悪生存期間(PFS)で副次評価項目は全生存期間(OS)、客観的奏効割合(ORR)、病勢制御割合(DCR)、QOLおよび安全性だった(図1)。主要評価項目の解析は増悪イベントが100例発生した2018年1月15日に行われ、全生存期間の最終解析は2020年9月1日をカットオフとして行われた。
図1. 試験デザイン