| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 大腸癌 | 一次治療 | 第2相 | 無増悪生存期間 | 欧州 | なし |
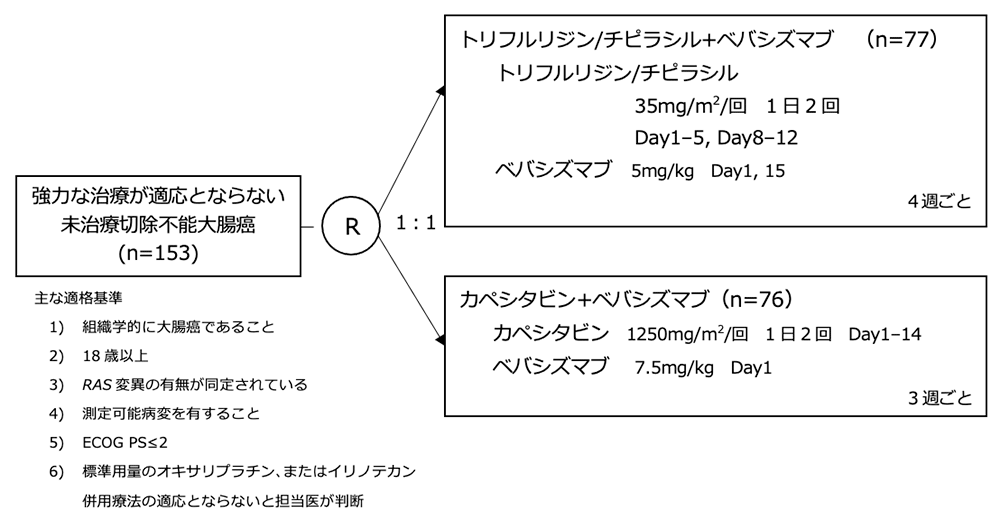
試験名 :TASCO1試験
レジメン:トリフルリジン/チピラシル+ベバシズマブ vs カペシタビン+ベバシズマブ
登録期間:2016年4月29日〜2017年3月29日
背景
進行再発大腸癌に対する一次治療として、オキサリプラチン併用療法やイリノテカン併用療法などの強力な治療が困難な症例に対しては、フッ化ピリミジンとベバシズマブ(BEV)の併用療法が推奨されている。RECOURSE試験の結果より標準治療に不応不耐となった切除不能大腸癌に対してトリフルリジン/チピラシル(FTD/TPI)が承認されているが、前臨床および第1/2相試験であるC-TASK FORCE試験よりFTD/TPI+BEV併用療法の有効性が示唆されている。今回、強力な治療が困難な症例に対する一次治療としてのFTD/TPI+BEV併用療法の有効性と安全性を、カペシタビン(Cape)+BEV併用療法を対照として検討する非比較第2相試験が行われた。
シェーマ
統計学的事項
主要評価項目:無増悪生存期間
本試験は非比較第2相試験として計画された。Cape+BEV群のPFSの中央値を9.0か月と想定し、期待HRを0.77(両側80%信頼区間)とし、最終患者登録から1年以内に100イベント以上が生じるには150例が必要と判断された。試験結果:
- 2016年4月~2017年3月に154例が登録された。1例はランダム化されたが、薬剤の投与が行われたなかったため、153例での検討となった(FTD/TPI+BEV群:77例、Cape+BEV群:76例)。
- 強力な治療が適応とならない理由はFTD/TPI+BEV群、Cape+BEV群で以下のとおりである。高齢(36% vs. 55%)、腫瘍量(20% vs. 18%)、PS(18% vs. 3%)、合併症(9% vs. 4%)、その他(17% vs. 20%)
- 2018年1月をPFSカットオフ(100イベント, FTD/TPI+BEV群:48例、Cape+BEV群:52例 )として解析した。
1. 無増悪生存期間(主要評価項目)
| 中央値 | 95%信頼区間 | HR (95%信頼区間) 0.71 (0.48–1.06) |
|
| FTD/TPI+BEV | 9.23ヶ月 | 7.59–11.56 | |
| Cape+BEV | 7.82ヶ月 | 5.55–10.15 |
割付因子(RAS 変異の有無、ECOG PS、国)および事前設定されたサブグループを通じて、FTD/TPI+BEV群においてPFSは良好な傾向であり、特に女性(HR=0.50)、RAS 変異型(HR=0.59)、左側結腸例(HR=0.50)、未切除例(HR=0.35)で顕著であった。
2. 全生存期間
| 中央値 | 95%信頼区間 | HR (95%信頼区間) 0.56 (0.32–0.98) |
|
| FTD/TPI+BEV | 18.00ヶ月 | 15.18–NA | |
| Cape+BEV | 16.16ヶ月 | 12.52–NA |
3. 奏効割合/病勢制御割合
| 奏効割合 | 病勢制御割合 | |
| FTD/TPI+BEV | 34% | 86% |
| Cape+BEV | 30% | 78% |
4. 有害事象
| FTD/TPI+BEV (n=77) | Cape+BEV (n=76) | |||
|---|---|---|---|---|
| Any Grade | Grade≥3 | Any Grade | Grade≥3 | |
| 好中球数減少 | 53% | 47% | 7% | 5% |
| 貧血 | 31% | 10% | 7% | 0% |
| 白血球数減少 | 20% | 10% | 3% | 3% |
| 血小板数減少 | 14% | 4% | 5% | 1% |
| 発熱性好中球減少症 | 5% | 5% | 4% | 4% |
| 下痢 | 53% | 1% | 43% | 8% |
| 悪心 | 47% | 3% | 18% | 0% |
| 食欲不振 | 38% | 0% | 20% | 1% |
| 疲労 | 36% | 4% | 30% | 4% |
| 嘔吐 | 29% | 5% | 12% | 1% |
| 脱毛症 | 22% | 0% | 0% | 0% |
| 口内炎 | 17% | 1% | 21% | 0% |
| 便秘 | 17% | 0% | 20% | 0% |
| 高血圧 | 16% | 13% | 13% | 5% |
| 手足症候群 | 4% | 0% | 51% | 12% |
- Grade3以上の有害事象割合:FTD/TPI+BEV群vs. Cape+BEV群=88% vs 70%。
- 治療開始遅延:FTD/TPI+BEV群 vs. Cape+BEV群=79% vs 74%
- 薬剤減量:FTD/TPI+BEV群 vs. Cape+BEV群=40% vs 49%
- 毒性中止:FTD/TPI+BEV群 vs. Cape+BEV群=18% vs 14%
- Grad3以上の骨髄抑制、悪心、嘔吐、高血圧はFTD/TPI+BEV群において頻度が多かった。
- Grad3以上の手足症候群、下痢はCape+BEV群において頻度が多かった。
結語
FTD/TPI+BEV併用療法は強力な治療に適応とならない未治療切除不能大腸癌患者に対し有望な抗腫瘍効果を示し、安全性プロファイルは忍容可能で、臨床的に問題となるようなQoLへの影響もなかった。
関連論文
・ Moiseyenko, V.; Saunders, M.P.; Wasan, H.S. et al. QoL from TASCO1: Health-related quality of life of trifluridine/tipiracil-bevacizumab and capecitabine-bevacizumab as first-line treatments in metastatic colorectal cancer patients not eligible for intensive chemotherapy—Results from the TASCO1 phase II study. Journal of Clinical Oncology. 2019, 37, 676-676.
執筆:愛知県がんセンター病院 薬物療法部 レジデント 緒方 貴次 先生
監修:関西医科大学付属病院 がんセンター 学長特命准教授 佐竹 悠良 先生
監修:関西医科大学付属病院 がんセンター 学長特命准教授 佐竹 悠良 先生