| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 大腸癌 | 三次治療以降 | 第1b/2相 | 奏効割合 | 国内 | あり |
試験名 :BiTS
レジメン:トリフルリジン・チピラシル+ベバシズマブ
登録期間:2017年10月〜2018年1月
背景
トリフルリジン・チピラシル(FTD/TPI)とベバシズマブ(BEV)との併用療法は切除不能大腸癌に対して高い抗腫瘍効果を示すことが報告されてきた1,2)。しかし、従来のFTD/TPI+BEV併用療法ではFTD/TPIは4週サイクルのうちday1-5、day8-12に投与、BEVは2週毎の投与と用法が複雑であることに加え、BEV併用により有害事象が増強されるという問題点があった。そこで、用法の簡略化と有害事象軽減を期待し、隔週FTD/TPI +BEV併用療法の有効性と安全性を評価するために本試験(BiTS試験)を実施した。
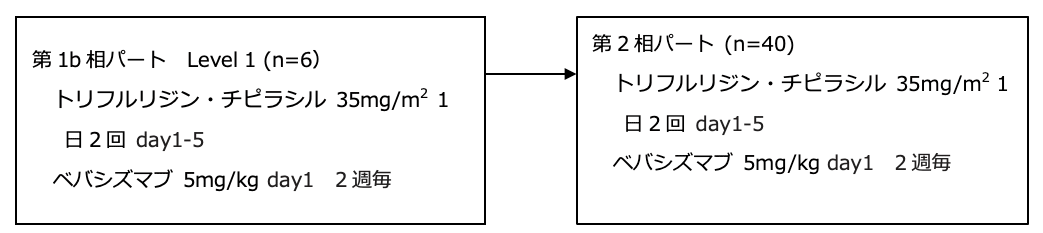
シェーマ
主な適格基準
- 5-FU、オキサリプラチン、イリノテカン、血管新生阻害薬、抗EGFR抗体薬(RAS 遺伝子野生型の場合)に不応もしくは不耐
- ≧20歳
- PS 0-1
- RECIST version 1.1による測定可能病変を有する
統計学的事項
主要評価項目:16週時点での無増悪生存(PFS)率
期待値38.7%、閾値15%、片側α=0.025、β=0.1、不適格例を考慮して目標症例数は45例となった。本試験は第1b相パートと第2相パートからなる。第1b相パートではLevel 1(FTD/TPI 35mg/2)に6例登録し、用量制限毒性(DLT)が2例以下であればLevel 1が第2相パートの推奨用量(RP2D)となる。DLTが3例以上であればLevel 0(FTD/TPI 30mg/2)に6例を登録する。第2相パートではRP2Dで40例登録する。
試験結果:
- 2017年10月〜2018年1月に国内15施設から46例が登録された。
- Level1においてDLTは認められず、Level1がRP2Dに決定された。
- 2例がプロトコール治療を受けておらず44例が解析対象となった。フォローアップ期間中央値は15.36カ月であった。
1. 無増悪生存期間(主要評価項目)
| 95%信頼区間 | P値 | ||
|---|---|---|---|
| 16週時点でのPFS率 | 40.9% | 26.3-56.8% | <.0001 |
| PFS中央値 | 4.29ヶ月 | 2.54-5.83カ月 |
2. 治療成功期間
| 95%信頼区間 | ||
|---|---|---|
| 治療成功期間中央値 | 4.16ヶ月 | 2.39-5.82ヶ月 |
3. 全生存期間
| 95%信頼区間 | ||
|---|---|---|
| 生存期間中央値 | 10.86ヶ月 | 8.32-13.68ヶ月 |
4. 病勢制御割合
| Total | n=44 | 95%信頼区間 |
|---|---|---|
| CR | 0 (0%) | |
| PR | 0 (0%) | |
| SD | 26 (59.1%) | |
| PD | 17 (38.6%) | |
| Other | 1 (2.3%) | |
| 病勢制御割合 | 59.1% | 43.3-73.7% |
5. 有害事象
| Grade, % | ||||||
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | All | |
| 白血球減少 | 16 | 36 | 16 | 0 | 0 | 68 |
| 好中球減少 | 7 | 41 | 16 | 0 | 0 | 64 |
| 貧血 | 41 | 39 | 9 | 0 | 0 | 89 |
| 血小板数減少 | 36 | 7 | 5 | 0 | 0 | 48 |
| 発熱性好中球減少症 | 0 | 0 | 0 | 0 | 0 | 0 |
| 高血圧 | 14 | 36 | 41 | 0 | 0 | 91 |
| 食欲不振 | 36 | 23 | 9 | 0 | 0 | 68 |
| 尿蛋白 | 32 | 30 | 7 | 0 | 0 | 69 |
| 疲労 | 32 | 32 | 0 | 0 | 0 | 64 |
| 悪心 | 39 | 14 | 7 | 0 | 0 | 60 |
| 末梢性感覚ニューロパチー | 48 | 2 | 2 | 0 | 0 | 52 |
| 口内炎 | 23 | 7 | 0 | 0 | 0 | 30 |
| 嘔吐 | 16 | 7 | 0 | 0 | 0 | 23 |
結語
隔週FTD/TPI+BEV併用療法は有望な抗腫瘍効果と良好な忍容性を示した。
関連論文
1) Kuboki Y, Nishina T, Shinozaki E, et al. TAS-102 plus bevacizumab for patients with metastatic colorectal cancer refractory to standard therapies (C-TASK FORCE): an investigator-initiated, open-label, single-arm, multicentre, phase 1/2 study. Lancet Oncol. 2017 Sep;18(9):1172-1181. [Pubmed] [C-TASK FORCE]
2) Pfeiffer P, Yilmaz M, Möller S, et al. TAS-102 with or without bevacizumab in patients with chemorefractory metastatic colorectal cancer: an investigator-initiated, open-label, randomised, phase 2 trial. Lancet Oncol. 2020 Mar;21(3):412-420. [Pubmed]
執筆:神奈川県立がんセンター 消化器内科 医長 古田 光寛 先生
監修:愛知県がんセンター病院 薬物療法部 医長 舛石 俊樹 先生
監修:愛知県がんセンター病院 薬物療法部 医長 舛石 俊樹 先生