| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 大腸癌 | 一次治療 | メタアナリシス | 全生存期間 | global | なし |
試験名 :なし(FOLFOXIRI+ベバシズマブに関するメタアナリシス)
レジメン:FOLFOXIRI+ベバシズマブ vs FOLFOX+ベバシズマブ / FOLFIRI+ベバシズマブ
登録期間:なし(系統的レビュー)
背景
切除不能大腸癌に対する一次治療としてのベバシズマブ(BEV)とFOLFOXIRI(フルオロウラシル+ロイコボリン+オキサリプラチン+イリノテカン)併用レジメンは、従来のBEV併用FOLFOX(フルオロウラシル+ロイコボリン+オキサリプラチン)またはFOLFIRI(フルオロウラシル+ロイコボリン+イリノテカン)レジメンと比較して血液毒性と消化器毒性を高頻度に認めるものの、治療成績が良好であることが複数のランダム化第2相または第3相試験によって報告されている。この結果を受けて、FOLFOXIRI+BEV療法は世界中のほとんどのガイドラインで一次治療の選択肢として推奨されている。しかしながら、過去の臨床試験では主要評価項目が全生存期間ではなく無増悪生存期間だったため、FOLFOXIRIレジメンの有害事象が許容されるほどの全生存期間の延長効果は証明されていない。さらに、FOLFOXIRIレジメンの効果が期待できる臨床的または分子的特徴の解析も重要な課題である。この系統的レビューでは、従来の2剤併用レジメン+BEVに対するFOLFOXIRI+BEVの全生存期間の延長効果としての付加価値と、FOLFOXIRIレジメンの効果と関連する治療開始時の患者背景因子および腫瘍因子の同定を検証するためのロバスト推定(観測値に外れ値が含まれている可能性を考え、その影響を抑えることを目的とした統計手法)を行った。
シェーマ
統計学的事項
主要評価項目:全生存期間
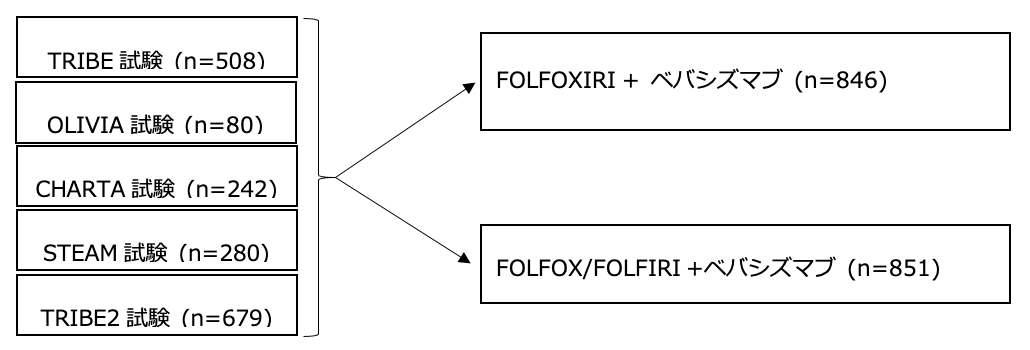
切除不能大腸癌に対する一次治療としてFOLFOXIRI+BEVと2剤併用療法+BEVを比較検討した臨床試験を2019年1月時点で検索した結果、TRIBE試験1)(第3相試験、対照群はFOLFIRI+BEV)、OLIVIA試験2)(第2相試験;対照群はFOLFOX+BEV)、CHARTA試験3)(第2相試験;対照群はFOLFOX+BEV)、STEAM試験4)(第2相試験;対照群はFOLFOX+BEV)、TRIBE2試験5)(第3相試験;対照群はFOLFOX+BEV)の5つの臨床試験が抽出され、IPD(individual patient data)を収集した。IPDを用いた系統的レビューとメタアナリシスはPRISMAガイドライン(システマティックレビューを行なう際の標準的手法)に準拠して施行された。試験結果:
- すべての臨床試験でMERGE checklistの基準は満たしており、quality scoreはB1(バイアスの危険性は低から中程度のクオリティ)。
- 全1797例のうち、STEAM試験の92例はsequential FOLFOXIRIとして2剤併用療法との交互治療が導入されていたため、メタアナリシスからは除外した。IPDが収集可能であった1697例を解析対象とした。
- 851例(50.1%)が2剤併用療法+BEV群、846例(49.9%)がFOLFOXIRI+BEV群であった。2剤併用療法として595例(69.9%)はFOLFOX+BEV、256例(30.1%)はFOLFIRI+BEVが使用されていた。
- 右側結腸癌の症例が34.8%、転移臓器が肝臓に限局していた症例が32.7%だった。
- RAS 変異は65%、BRAF 変異は9%の症例で観察された。
- FOLFOXIRI+BEV群で右側結腸癌症例(37.3%対32.3%)、転移臓器が肝臓に限局していた症例 (35.6%対29.9%)が多いことを除いては、2群間で背景因子の差異を認めなかった。
- 観察期間中央値は39.9か月(IQR 30.1-49.9か月)だった(FOLFOXIRI+BEV群38.9か月、2剤併用+BEV群 40.8か月)。
1. 全生存期間(主要評価項目)
| 中央値 | 95%信頼区間 | HR 0.81 (95%CI 0.72-0.91) P<0.001 |
|
| FOLFOXIRI+BEV群 | 28.9ヶ月 | 27.3-30.4か月 | |
| 2剤併用+BEV群 | 24.5ヶ月 | 23.0-25.9か月 |
- 予測5年生存率はFOLFOXIRI+BEV群で22.3% (95%CI 18.0-26.6%)、2剤併用+BEV群で10.7% (95%CI 6.6-14.8%)だった(p<0.001)。
- 5つの臨床試験の間での有意な不均一性を認めなかった(p=0.39; I2=2%)。
2. 無増悪生存期間
| 中央値 | 95%信頼区間 | HR 0.74 (95%CI 0.67-0.82) P<0.001 |
|
| FOLFOXIRI+BEV群 | 12.2ヶ月 | 11.6-12.8か月 | |
| 2剤併用+BEV群 | 9.9ヶ月 | 9.5-10.3か月 |
- 5つの臨床試験の間での有意な不均一性を認めなかった(p=0.19; I2=35%)。
- オキサリプラチンを使用した補助療法の有無と治療効果との間にボーダーラインの相互関係を認めた(p=0.058)。
3. 奏効割合
| 奏効割合 | OR 1.57 (95%CI 1.29-1.91) P<0.001 |
|
| FOLFOXIRI+BEV群 | 64.5% (545/845例) | |
| 2剤併用+BEV群 | 53.6% (456/850例) |
- 5つの臨床試験の間での有意な不均一性を認めなかった(p=1.00; I2=0%)。
4. 根治手術に移行できた割合
| R0切除割合 | OR 1.48 (95%CI 1.12-1.95) P=0.007 |
|
| FOLFOXIRI+BEV群 | 16.4% (139/845例) | |
| 2剤併用+BEV群 | 11.8% (100/850例) |
- 5つの臨床試験の間での有意な不均一性を認めなかった(p=0.33; I2=13%)。
- R0切除可能であった症例のうち、全生存期間中央値はFOLFOXIRI+BEV群で64.0か月、2剤併用+BEV群で52.6か月であり、治療アームによる全生存期間の差異を認めなかった(HR 0.79; 95%CI 0.50-1.24, P=0.667)。
5. 有害事象(Grade 3-4)
| FOLFOXIRI+BEV群 N=838 (%) | 2剤併用+BEV群 N=836 (%) | OR (95%CI) | P値 | |
|---|---|---|---|---|
| 好中球数減少 | 384 (45.8) | 180 (21.5) | 3.16 (2.54-3.92) | <0.001 |
| 発熱性好中球減少症 | 53 (6.3) | 31 (3.7) | 1.76 (1.12-2.78) | 0.019 |
| 貧血 | 21 (2.5) | 17 (2.0) | 1.22 (0.65-2.30) | 0.635 |
| 血小板減少症 | 14 (1.7) | 10 (1.2) | 1.34 (0.62-2.89) | 0.551 |
| 悪心 | 46 (5.5) | 25 (3.0) | 1.87 (1.14-3.05) | 0.016 |
| 嘔吐 | 33 (3.9) | 20 (2.4) | 1.67 (0.95-2.94) | 0.098 |
| 口内炎 | 43 (5.1) | 24 (2.9) | 1.83 (1.10-3.03) | 0.024 |
| 下痢 | 149 (17.8) | 70 (8.4) | 2.37 (1.75-3.21) | <0.001 |
| 神経毒性 | 33 (3.9) | 19 (2.3) | 1.75 (0.99-3.10) | 0.069 |
| 高血圧症 | 65 (7.8) | 65 (7.8) | 1.00 (0.70-1.43) | 0.938 |
| 静脈血栓症 | 46 (5.5) | 48 (5.7) | 0.95 (0.63-1.44) | 0.892 |
| 尿蛋白 | 10 (1.2) | 11 (1.3) | 0.91 (0.38-2.17) | 0.989 |
| 出血 | 7 (0.8) | 10 (1.2) | 0.70 (0.27-1.80) | 0.602 |
| 腸穿孔 | 11 (1.3) | 9 (1.1) | 1.19 (0.51-2.78) | 0.831 |
| 有害事象による死亡 | 19 (2.3) | 12 (1.4) | 1.60 (0.77-3.31) | 0.277 |
- 血液毒性や消化器毒性はFOLFOXIRI+BEV群で多く観察されたものの、有害事象による死亡については両群間に差異を認めなかった。
6. サブグループ解析:FOLFOXIRI+BEV療法の効果(OS)に関連する患者背景および腫瘍因子の検索
| FOLFOXIRI+BEV群 死亡イベント数(%) |
2剤併用+BEV群 死亡イベント数(%) |
HR(95%CI) | P値 | |
|---|---|---|---|---|
| ECOG PS 0 1-2 |
398/667 (59.7) 126/175 (72.0) |
441/656 (67.2) 149/192 (77.6) |
0.82 (0.71-0.94) 0.88 (0.69-1.12) |
0.492 |
| 年齢 <70歳 >70歳 |
436/707 (61.7) 91/139 (65.5) |
493/722 (68.3) 98/129 (76.0) |
0.82 (0.72-0.94) 0.72 (0.54-0.97) |
0.533 |
| 補助療法歴 なし あり |
492/782 (62.9) 35/63 (55.6) |
552/790 (69.9) 39/61 (63.9) |
0.79 (0.70-0.90) 1.04 (0.66-1.65) |
0.269 |
| 腫瘍部位 右側 左側 |
267/400 (66.8) 260/445 (58.4) |
185/255 (72.5) 367/535 (68.6) |
0.79 (0.64-0.97) 0.83 (0.72-0.97) |
0.656 |
| RAS/BRAF 変異 野生型/野生型 RAS 変異 BRAF 変異 |
99/177 (55.9) 289/422 (68.5) 53/61 (86.9) |
107/172 (62.2) 316/430 (73.5) 43/54 (79.6) |
0.83 (0.63-1.10) 0.82 (0.70-0.97) 1.11 (0.75-1.73) |
0.337 |
| 腫瘍部位-RAS/BRAF 右側-野生型 右側-RAS 変異 右側-BRAF 変異 左側-野生型 左側-RAS 変異 左側-BRAF 変異 |
21/44 (47.7) 113/168 (67.3) 34/39 (87.2) 78/132 (59.1) 173/250 (69.2) 19/22 (86.4) |
21/31 (67.7) 110/149 (73.8) 33/40 (82.5) 79/134 (59.0) 199/273 (72.9) 9/13 (69.2) |
0.44 (0.22-0.88) 0.80 (0.62-1.05) 1.04 (0.63-1.72) 0.97 (0.71-1.33) 0.85 (0.69-1.05) 1.77 (0.78-4.01) |
0.320 |
- FOLFOXIRI+BEV療法の生存期間延長効果と統計学的に有意に相関する患者背景因子および腫瘍因子を同定することはできなかった。
- オキサリプラチンを使用した補助療法の既往を有する症例では、2剤併用療法+BEVに対するFOLFOXIRI+BEVの生存期間延長効果を認めなかった。
- BRAF 変異症例では、2剤併用+BEV療法に対するFOLFOXIRI+BEV療法の生存期間延長効果を認めなかった。
結語
FOLFOXIRI+BEVは、2剤併用レジメンに比較して毒性が強い一方で、切除不能大腸癌症例の全生存期間を延長する上で臨床的に有意義な一次治療の選択肢であることが確認できた。オキサリプラチンを含む補助療法の既往がなく、右側結腸癌やRAS 変異型の特徴を有する若年の症例は、conversion手術の企図とは関係なく、FOLFOXIRI+BEVの適切な候補となる可能性が示唆された。
関連論文
1) Cremolini C, Loupakis F, Antoniotti C, et al: FOLFOXIRI plus bevacizumab versus FOLFIRI plus bevacizumab as first-line treatment of patients with metastatic colorectal cancer: Updated overall survival and molecular subgroup analyses of the open-label, phase 3 TRIBE study. Lancet Oncol 16:1306-1315, 2015. [Pubmed]
2) Gruenberger T, Bridgewater J, Chau I, et al: Bevacizumab plus mFOLFOX-6 or FOLFOXIRI in patients with initially unresectable liver metastases fromcolorectal cancer: The OLIVIA multinational randomised phase II trial. Ann Oncol 26:702-708, 2015. [Pubmed]
3) Schmoll H, Garlipp B, Junghanß C, et al: FOLFOX/bevacizumab +/- irinotecan in advanced colorectal cancer (CHARTA): Long term outcome. Ann Oncol 29, 2018. [Pubmed]
4) Hurwitz HI, Tan BR, Reeves JA, et al: Phase II randomized trial of sequential or concurrent FOLFOXIRI-bevacizumab versus FOLFOX-bevacizumab for metastatic colorectal cancer (STEAM). Oncologist 24:921-932, 2019. [Pubmed]
5) Cremolini C, Antoniotti C, Rossini D, et al: Upfront FOLFOXIRI plus bevacizumab and reintroduction after progression versus mFOLFOX6 plus bevacizumab followed by FOLFIRI plus bevacizumab in the treatment of patients with metastatic colorectal cancer (TRIBE2): A multicentre, open-label, phase 3, randomised, controlled trial. Lancet Oncol 21:497-507, 2020. [Pubmed]
執筆:九州がんセンター 消化管外科 中島雄 一郎 先生
監修:愛知県がんセンター病院 薬物療法部 医長 坂東 英明 先生
監修:愛知県がんセンター病院 薬物療法部 医長 坂東 英明 先生