| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 大腸癌 | 一次治療 | 第3相 | 無増悪生存期間 | 海外(イタリア) | なし |
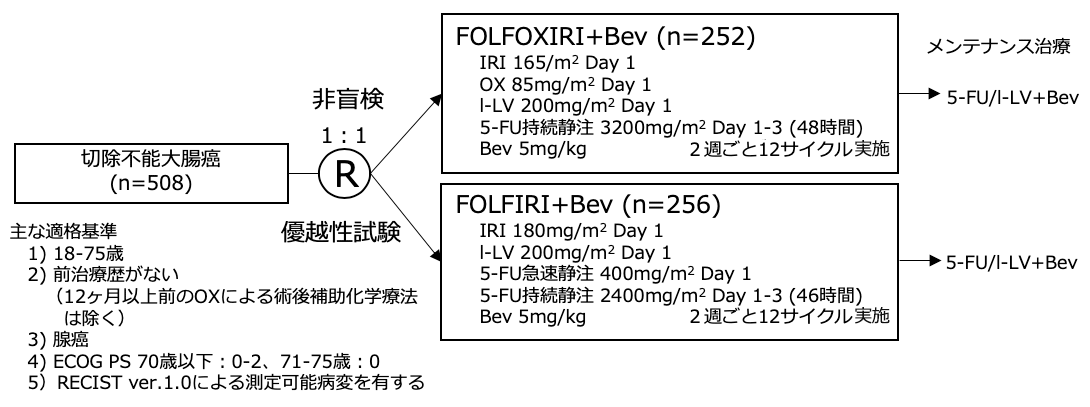
試験名 :TRIBE(OS update+RAS/BRAF status)
レジメン:FOLFOXIRI+Bev vs FOLFIRI+Bev
登録期間:2008年7月〜2011年5月
背景
FOLFOXIRI+BevとFOLFIRI+Bevを比較した第3相試験であるTRIBE試験において、FOLFOXIRI+Bevは、無増悪生存期間(PFS)と奏効割合(RR)を改善した。また、FOLFOXIRIとFOLFIRIを比較した別の第3相試験の長期フォローアップ解析より、FOLFOXIRI群における良好な奏効割合やPFSが全生存期間(OS)を延長させていることが示唆された。しかしながら、3剤併用レジメンを一次治療で使用することがOS延長に寄与するかどうかや、一次治療でのPFSがOSのサロゲートマーカーとなるかどうかの結論がまだ出ていなかった。そのため、一次治療におけるFOLFOXIRI+Bevの位置づけを確認するために、長期フォローアップ解析によりFOLFOXIRI+BevのOSへの寄与を明らかにすることが必要であると考えられた。
また、大腸癌の予後予測因子として確立したRAS/BRAF遺伝子変異別の検討を行うため、RAS遺伝子検査およびBRAF遺伝子検査を行った。
また、大腸癌の予後予測因子として確立したRAS/BRAF遺伝子変異別の検討を行うため、RAS遺伝子検査およびBRAF遺伝子検査を行った。
シェーマ
統計学的事項
主要評価項目:無増悪生存期間
本試験の主要評価項目はPFSとした。HRを0.75、検出力を80%、両側α=0.05と設定すると、450例の登録、379イベントが必要とされた。試験結果:
- 2008年7月〜2011年5月の間にイタリアの34施設より508例が登録され、FOLFOXIRI+Bev群に252例、FOLFIRI+Bev群に256例が割付られた。
- 両群の患者背景に大きな隔たりは認めなかったが、FOLFOXIRI+Bev群で右側結腸原発例が多く認められた(34.9% vs 23.8%, p=0.02)。
- 本解析のデータカットオフは2014年7月31日。観察期間中央値は48.1ヶ月で、508例中374例(74%)が死亡していた。
試験結果:
【遺伝子解析】
- KRAS/BRAF遺伝子変異については、KRAS codon 12,13,61 およびBRAF codon 600の解析を行うことを事前に計画しており、ITTの80%にあたる407例で実施された。
- また、追加のRAS検査として、KRAS codon 59, 117, 146 およびNRAS codon 12,13,59, 61, 117, 146についても追加で解析を行うこととし、357例で実施され、遺伝子status別にサブグループ解析を行った。
1. 全生存期間(ITT)
| 中央値 | 95% CI | HR 0.80 (95%C.I. 0.65-0.98) p=0.03 |
|
| FOLFOXIRI+Bev(n=252) | 29.8ヶ月 | 26.0-34.3 | |
| FOLFIRI+Bev(n=256) | 25.8ヶ月 | 22.5-29.1 |
2. 無増悪生存期間(ITT)
| 中央値 | 95% CI | HR 0.77 (95%C.I. 0.65-0.93) p=0.006 |
|
| FOLFOXIRI+Bev(n=252) | 12.3ヶ月 | 11.0-13.3 | |
| FOLFIRI+Bev(n=256) | 9.7ヶ月 | 9.2-10.9 |
3. 全生存期間(遺伝子変異/治療群別)
| 中央値 | 95% CI | ||
| RAS/BRAF野生型 FOLFOXIRI+Bev(n=48) FOLFIRI+Bev(n=45) |
41.7ヶ月 33.5ヶ月 |
30.1-53.1 22.3-39.7 |
HR 0.77 (95%C.I. 0.46-12.7) |
| RAS変異型 FOLFOXIRI+Bev(n=117) FOLFIRI+Bev(n=119) |
27.3ヶ月 23.9ヶ月 |
22.0-31.3 20.5-27.9 |
HR 0.88 (95%C.I. 0.65-1.18) |
| BRAF変異型 FOLFOXIRI+Bev(n=16) FOLFIRI+Bev(n=12) |
19.0ヶ月 10.7ヶ月 |
8.2-28.6 3.1-24.8 |
HR 0·54 (95%C.I. 0·24–1·20) |
4. 無増悪生存期間(遺伝子変異/治療群別)
| 中央値 | 95% CI | ||
| RAS/BRAF野生型 FOLFOXIRI+Bev(n=48) FOLFIRI+Bev(n=45) |
13.7ヶ月 12.2ヶ月 |
10.1-18.1 9.5-14.4 |
HR 0.85 (95%C.I. 0.55-1.30) |
| RAS変異型 FOLFOXIRI+Bev(n=117) FOLFIRI+Bev(n=119) |
12.0ヶ月 9.5ヶ月 |
10.3-13.2 8.8-11.1 |
HR 0.78 (95%C.I. 0.60-1.02) |
| BRAF変異型 FOLFOXIRI+Bev(n=16) FOLFIRI+Bev(n=12) |
7.5ヶ月 5.5ヶ月 |
5.1-15.0 1.6-11.2 |
HR 0.57 (95%C.I. 0.27-1.23) |
全生存期間、無増悪生存期間ともに、治療レジメンと遺伝子変異との間に有意な相関は認められなかった。
結語
長期フォローアップ解析により、切除不能大腸癌に対する一次治療においてFOLFOXIRI+Bevは、FOLFIRI+Bevと比較し、全生存期間の延長を示した。また、遺伝子変異の有無による治療効果の差は認められなかった。
執筆:静岡県立静岡がんセンター 消化器内科 レジデント 古田 光寛 先生
監修:静岡県立静岡がんセンター 治験管理室 部長、消化器内科 医長 山﨑 健太郎 先生
監修:静岡県立静岡がんセンター 治験管理室 部長、消化器内科 医長 山﨑 健太郎 先生