| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 大腸癌 | 一,二次治療 | 第3相 | 無増悪生存期間2 | 海外 (イタリア) | なし |
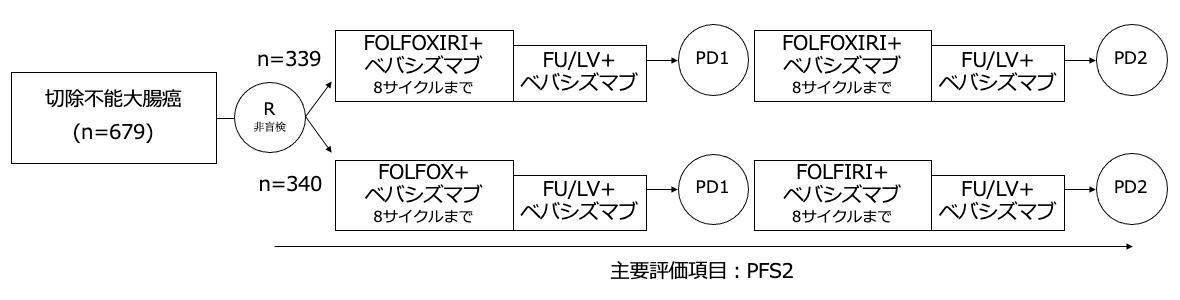
試験名 :TRIBE2
レジメン:FOLFOXIRI+BEV vs FOLFOX+BEV→FOLFIRI+BEV
登録期間:2015年2月16日〜2017年5月15日
背景
切除不能大腸癌に対する一次治療として、FOLFOXIRI+ベバシズマブ(BEV)療法の有効性はTRIBE試験など複数の臨床試験で確認され、ガイドラインにも重要な選択肢として記載されている。しかし、3剤の殺細胞性抗癌剤と2剤併用の逐次治療に対する真の有効性は明確ではなかった。そこで切除不能大腸癌に対する2剤併用レジメンの逐次治療(対照群)に対する3剤併用レジメン(試験治療群)の優越性を検証するためにTRIBE2試験が行われた。
シェーマ
主な適格基準
- 組織学的に腺癌と診断された切除不能進行大腸癌
- 年齢:18-75歳
- ECOG PS : 0-2(年齢70歳以下)、0 (年齢71-75歳)
- RECIST v1.1による測定可能病変を有する
統計学的事項
主要評価項目:無増悪生存期間2(PFS2)
15ヶ月時点の無増悪生存期間2(PFS2: 無作為化から初回PD後に投与された治療においてのPDまたは死亡までの期間)割合を逐次治療群50%に対してFOLFOXIRI+BEV群60% (HR=0.77)となることを見込み、両側α=0.05、検出力80%とし、466のイベントが必要と算出され、必要症例数は654とされた。試験結果:
- 679例が登録され、FOLFOXIRI+BEV群に339例、逐次治療群に340例が登録された。少なくとも治療が一度でも実施された各336例で安全性の解析が行われた。
- 観察期間の中央値は35.9ヶ月で、PFS2のイベントをFOLFOXIRI+BEV群の77%、逐次治療群の80%で認められた。
- 転移巣に対するR0切除はFOLFOXIRI+BEV群において17%、逐次治療群において12%で実施された。
- 初回の病勢増悪後に生存していた570例のうち、FOLFOXIRI+BEV群の274例中224例(82%)、逐次治療群の296例中259例(88%)で二次治療が実施された。プロトコール規定の二次治療(FOLFOIXRI+BEV群ではFOLFOXIRI+BEV療法、逐次治療群ではFOLFIRI+BEV療法)はFOLFOXIRI+BEV群の224例中132例(59%)、逐次治療群の259例中201例(78%)で実施された。
1. PFS2(主要評価項目)
| 中央値 | 95%信頼区間 | HR (95%信頼区間) 0.74 (0.63-0.88) p=0.0005 |
|
| FOLFOXIRI+BEV群 | 19.2ヶ月 | 17.3-21.4 | |
| 逐次治療群 | 16.4ヶ月 | 15.1-17.5 |
2. PFS1 (一次治療PFS)
| 中央値 | 95%信頼区間 | HR (95%信頼区間) 0.74 (0.63-0.86) p=0.0002 |
|
| FOLFOXIRI+BEV群 | 12.0ヶ月 | 11.1-12.9 | |
| 逐次治療群 | 9.8ヶ月 | 9.0-10.5 |
3. 二次治療PFS
| 中央値 | 95%信頼区間 | HR (95%信頼区間) 0.87 (0.73-1.04) p=0.11 |
|
| FOLFOXIRI+BEV群 | 6.2ヶ月 | 5.6-6.6 | |
| 逐次治療群 | 5.6ヶ月 | 4.9-6.4 |
4. 全生存期間
| 中央値 | 95%信頼区間 | HR (95%信頼区間) 0.82 (0.68-0.98) p=0.032 |
|
| FOLFOXIRI+BEV群 | 27.4ヶ月 | 23.7-30.0 | |
| 逐次治療群 | 22.5ヶ月 | 20.7-24.8 |
5. 奏効割合
| 奏効割合 | OR (95%信頼区間) | CR | PR | |
|---|---|---|---|---|
| FOLFOXIRI+BEVv群 | 62% | 1.61 (1.19-2.18) p=0.0023 |
3% | 59% |
| 逐次治療群 | 50% | 4% | 46% |
6. 有害事象 (一次治療)
| FOLFOXIRI+BEV群 (n=336) | 逐次治療群 (n=336) | |||||
|---|---|---|---|---|---|---|
| Grade 1,2 | Grade 3 | Grade 4 | Grade 1,2 | Grade 3 | Grade 4 | |
| ANY | 50% | 38% | 9% | 30% | 48% | 21% |
| 好中球数減少 | 29% | 14% | 7% | 23% | 31% | 19% |
| 発熱性好中球減少症 | NA | 3% | 0 | NA | 4% | 2% |
| 下痢 | 35% | 5% | <1 | 50% | 16% | 1% |
| 悪心 | 42% | 3% | 0 | 49% | 6% | 0 |
| 嘔吐 | 17% | 1% | 0 | 29% | 3% | 0 |
| 無力感 | 47% | 6% | 0 | 50% | 7% | 0 |
| 末梢神経障害 | 58% | 1% | 0 | 47% | 2% | 0 |
| 高血圧症 | 19% | 10% | 0 | 16% | 7% | 0 |
| 静脈血栓症 | 4% | 5% | 1% | 6% | 4% | 0 |
- 重篤な有害事象をFOLFOXIRI+BEV群の25%に、逐次治療群の17%に認めた。
- 治療関連死をFOLFOXIRI+BEV群の8例に、逐次治療群の4例に認めた。
- 減量をFOLFOXIRI+BEV群の58%、逐次治療群の47%で要し、両群ともに3%で有害事象による治療中止を認めた。
結語
切除不能大腸癌に対するFOLFOXIRI+BEVによる導入化学療法後の維持治療、および初回増悪後に再導入する治療戦略は、本試験の適格基準に合致する忍容性良好な治療対象に対する有効な一次薬物療法と考えられる。
執筆:静岡県立静岡がんセンター 消化器内科 副医長 伏木 邦博 先生
監修:関西医科大学附属病院 がんセンター 学長特命准教授 佐竹 悠良 先生
監修:関西医科大学附属病院 がんセンター 学長特命准教授 佐竹 悠良 先生