| 対象疾患 | 治療ライン | 研究の相 | 評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 進行消化管間質腫瘍(GIST) | 三次治療以降 | 第3相 | 無増悪生存期間(中央判定) | 国際 | あり |
試験名 :GRID試験
レジメン:レゴラフェニブ vs プラセボ
登録期間:2011年1月4日〜2011年8月18日
背景
消化管間質腫瘍(GIST)は消化管で発生する最も一般的な肉腫であり、世界中で年間、100万人あたり約10例に発症する。早期発見例では外科的切除が可能であるが、約40%が再発し、転移を生じる。殺細胞性化学療法は他の肉腫には有効性を示すが、転移性GISTには効果を示さない。GISTの約85%はチロシンキナーゼ受容体をコードするKITの機能獲得変異によって引き起こされ、約8%はPDGFRAの機能獲得変異に関連している。
KIT、PDGFRAおよびABLの選択的チロシンキナーゼ阻害薬であるイマチニブは進行した転移性症例に対する治療、術後補助療法の両者でGISTの臨床転帰を大幅に改善した。しかし、イマチニブは約15%に一次耐性を生じ、80%以上がKITエクソンにある二次耐性変異により最終的に病勢進行に至る。
イマチニブ耐性後に臨床的有効性を示した最初の薬剤がスニチニブである。スニチニブはイマチニブよりも野生型KITキナーゼに対して、より強力な活性を持ち、関連する他のいくつかのシグナル伝達経路も阻害する(VEGFR1[FLT1]、VEGFR2[KDR]、VEGFR3[FLT4]、FLT3、RET)。イマチニブ耐性症例を対象にスニチニブの有効性を検証した無作為化比較第3相試験では、プラセボに比して、増悪までの期間に有意な改善を示した。しかし、スニチニブに対する薬剤耐性は一般的に治療から1年以内に生じ、本試験開始時点でチロシンキナーゼ阻害薬耐性GISTに対する他の有効な治療法は開発されていない。
レゴラフェニブは、腫瘍血管新生(VEGFR1-3、TEK)、腫瘍形成(KIT、RET、RAF1、BRAF)、腫瘍微小環境(PDGFR、FGFR)に関わる複数のキナーゼを標的とする新規の経口マルチキナーゼ阻害薬であり、前臨床試験ではヒトGISTおよび他の腫瘍モデルに対して抗腫瘍活性を示した。イマチニブ・スニチニブ不応の転移性GISTに対する第2相試験が行われ、数例のPRを含む高率な持続的病勢制御、無増悪生存期間中央値 10ヶ月を示し、Grade 3の有害事象も高血圧・手足の皮膚反応と予想されたものであった。これらの結果に基づき、イマチニブ・スニチニブ不応の転移性GISTに対するレゴラフェニブの有効性を検証する目的に本試験が行われた。
KIT、PDGFRAおよびABLの選択的チロシンキナーゼ阻害薬であるイマチニブは進行した転移性症例に対する治療、術後補助療法の両者でGISTの臨床転帰を大幅に改善した。しかし、イマチニブは約15%に一次耐性を生じ、80%以上がKITエクソンにある二次耐性変異により最終的に病勢進行に至る。
イマチニブ耐性後に臨床的有効性を示した最初の薬剤がスニチニブである。スニチニブはイマチニブよりも野生型KITキナーゼに対して、より強力な活性を持ち、関連する他のいくつかのシグナル伝達経路も阻害する(VEGFR1[FLT1]、VEGFR2[KDR]、VEGFR3[FLT4]、FLT3、RET)。イマチニブ耐性症例を対象にスニチニブの有効性を検証した無作為化比較第3相試験では、プラセボに比して、増悪までの期間に有意な改善を示した。しかし、スニチニブに対する薬剤耐性は一般的に治療から1年以内に生じ、本試験開始時点でチロシンキナーゼ阻害薬耐性GISTに対する他の有効な治療法は開発されていない。
レゴラフェニブは、腫瘍血管新生(VEGFR1-3、TEK)、腫瘍形成(KIT、RET、RAF1、BRAF)、腫瘍微小環境(PDGFR、FGFR)に関わる複数のキナーゼを標的とする新規の経口マルチキナーゼ阻害薬であり、前臨床試験ではヒトGISTおよび他の腫瘍モデルに対して抗腫瘍活性を示した。イマチニブ・スニチニブ不応の転移性GISTに対する第2相試験が行われ、数例のPRを含む高率な持続的病勢制御、無増悪生存期間中央値 10ヶ月を示し、Grade 3の有害事象も高血圧・手足の皮膚反応と予想されたものであった。これらの結果に基づき、イマチニブ・スニチニブ不応の転移性GISTに対するレゴラフェニブの有効性を検証する目的に本試験が行われた。
シェーマ
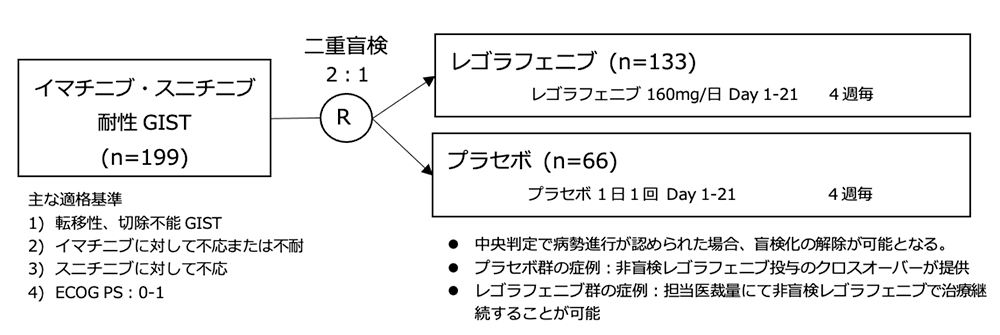
統計学的事項
主要評価項目:無増悪生存期間
199人の患者を無作為化し、目標治療効果を無増悪生存期間の100%改善、無作為化比を2:1(レゴラフェニブ:プラセボ)、片側α=0.01、検出力 94%で設定すると、最終的な無増悪生存期間解析には144のイベントが必要であった。試験結果:
- 2011年1月4日〜2011年8月18日までに17ヶ国57施設より240例がスクリーニングを受け、その内、199例が無作為割付けされた(レゴラフェニブ群 n=133、プラセボ群 n=66)。レゴラフェニブ群の1例は試験治療開始前に死亡した。
- 解析は144の増悪イベントに達してから実施され、イベントの内訳はレゴラフェニブ群 81イベント(61%)、プラセボ群 63イベント(95%)であった。
1. 患者背景
| N (%) | レゴラフェニブ群 (N=133) | プラセボ群 (N=66) | |
|---|---|---|---|
| 年齢 | 中央値 (範囲) | 60 (51-67) | 61 (48-66) |
| 性別 | 男性 女性 |
85 (64) 48 (36) |
42 (64) 24 (36) |
| 人種 | 白人 黒人 or アフリカ系アメリカ人 アジア人 未報告 or 不明 |
90 (68) 0 (0) 34 (26) 9 (7) |
45 (68) 1 (2) 16 (24) 4 (6) |
| ECOG PS | 0 1 |
73 (55) 60 (45) |
37 (56) 29 (44) |
| 薬物療法歴 | 2ライン 3ライン以上 |
74 (56) 59 (44) |
39 (59) 27 (41) |
| イマチニブ投与期間 | 6ヶ月以下 6-18ヶ月 18ヶ月を超える |
18 (14) 26 (20) 89 (67) |
4 (6) 7 (11) 55 (83) |
- レゴラフェニブ群と比して、プラセボ群において前治療としてのイマチニブ投与期間が18ヶ月以上の症例が多かったものの、ベースラインの特徴や前治療は両群間でほぼ偏りはなかった。
- 193例(97%)がイマチニブとスニチニブの両者に不応であり、イマチニブ不耐例はわずか6例(3%)のみであった。
- 86例(43%)は3ライン以上の薬物療法歴を有した。
2. 投与状況
- 二重盲検期間中、レゴラフェニブ群 38例(29%)、プラセボ群 7例(11%)が非盲検レゴラフェニブ投与に移行せず、試験治療を中止した。試験治療終了の最も一般的な理由は、画像による病勢進行確認であった。
- データカットオフ時点(2016年1月26日)でレゴラフェニブ群 53例(40%)、プラセボ群 3例(5%)が二重盲検治療を継続していた。レゴラフェニブ群の41例(31%)は病勢進行後も非盲検レゴラフェニブで投与を継続し、24例(18%)は解析時も投与継続されていた。プラセボ群では56例(85%)が病勢進行後に非盲検レゴラフェニブ投与にクロスオーバーし、33例(50%)が解析時に投与継続されていた。
- レゴラフェニブ群では計画容量の78.0%が投与され、プラセボ群では83.8%の投与を受けた。
[二重盲検期間中の治療期間]
| 中央値 | (四分位範囲) | 平均 | (標準偏差) | |
|---|---|---|---|---|
| レゴラフェニブ群 | 22.9週 | (9.3-28.6) | 20.2週 | (11.6) |
| プラセボ群 | 7.0週 | (5.1-11.3) | 9.1週 | (5.9) |
[二重盲検期間中の1日投与量]
| 中央値 | (四分位範囲) | 平均 | (標準偏差) | |
|---|---|---|---|---|
| レゴラフェニブ群 | 146.8mg | (125.1-160.0) | 139.8mg | (22.9) |
| プラセボ群 | 160.0mg | (16.0-160.0) | 159.9mg | (3.0) |
3. 無増悪生存期間(中央判定:主要評価項目)
| N | 中央値 (四分位範囲) |
3ヶ月PFS割合 (95%信頼区間) |
6ヶ月PFS割合 (95%信頼区間) |
|
|---|---|---|---|---|
| レゴラフェニブ群 | 133 | 4.8ヶ月 (1.4-9.2) |
60% (51-68) |
38% (29-48) |
| プラセボ群 | 66 | 0.9ヶ月 (0.9-1.8) |
11% (3-18) |
0% (0-0) |
HR 0.27 (95%信頼区間 0.19-0.39), p<0.0001
4. 無増悪生存期間(主治医判定)
| N | 中央値 | (四分位範囲) | |
|---|---|---|---|
| レゴラフェニブ群 | 133 | 7.4ヶ月 | (2.7-算出不可) |
| プラセボ群 | 66 | 1.7ヶ月 | (0.9-2.7) |
HR 0.22 (95%信頼区間 0.14-0.35), p<0.0001
5. プラセボ群の非盲検レゴラフェニブにおける無増悪生存期間 (主治医判定)
| N | 中央値 | (四分位範囲) | |
|---|---|---|---|
| 非盲検レゴラフェニブ | 56 | 5.0ヶ月 | (3.1-8.7) |
6. 全生存期間
| N | イベント | 中央値 | |
|---|---|---|---|
| レゴラフェニブ群 | 133 | 29 (22%) | 未到達 |
| プラセボ群 | 66 | 17 (26%) | 未到達 |
HR 0.77 (95%信頼区間 0.42-1.41), p=0.199
7. 奏効割合・病勢制御割合
| レゴラフェニブ群 (n=133) | プラセボ群 (n=66) | p値 | |
|---|---|---|---|
| CR PR SD |
0 6 (4.5%) 95 (71.4%) |
0 1 (1.5%) 22 (33.3%) |
― |
| 奏効割合 | 6 (4.5%) | 1 (1.5%) | ― |
| 病勢制御割合* | 70 (52.6%) | 6 (9.1%) | <0.0001 |
* CR+PR+12週以上のSD
8. 二重盲検期間に10%以上の頻度で生じた薬剤関連有害事象 (CTCAE v4.0)
| N (%) | レゴラフェニブ群 (n=132*) | プラセボ群 (n=66) | ||||
|---|---|---|---|---|---|---|
| 全Grade | Grade 3 | Grade 4 | 全Grade | Grade 3 | Grade 4 | |
| 全有害事象 | 130 (98) | 77 (58) | 2 (2) | 45 (68) | 5 (8) | 1 (2) |
| 手掌・足底発赤知覚不全症候群 | 74 (56) | 26 (20) | 0 | 9 (14) | 0 | 0 |
| 高血圧 | 64 (49) | 30 (23) | 1 (1) | 11 (17) | 2 (3) | 0 |
| 下痢 | 53 (40) | 7 (5) | 0 | 3 (5) | 0 | 0 |
| 疲労 | 51 (39) | 3 (2) | 0 | 18 (27) | 0 | 0 |
| 口腔粘膜炎 | 50 (38) | 2 (2) | 0 | 5 (8) | 1 (2) | 0 |
| 脱毛症 | 31 (24) | 2 (2) | 0 | 1 (2) | 0 | 0 |
| 嗄声 | 29 (22) | 0 | 0 | 3 (5) | 0 | 0 |
| 食欲不振 | 27 (21) | 0 | 0 | 5 (8) | 0 | 0 |
| 斑状丘疹状皮疹 | 24 (18) | 3 (2) | 0 | 2 (3) | 0 | 0 |
| 悪心 | 21 (16) | 1 (1) | 0 | 6 (9) | 1 (2) | 0 |
| 便秘 | 20 (15) | 1 (1) | 0 | 4 (6) | 0 | 0 |
| 筋肉痛 | 18 (14) | 1 (1) | 0 | 6 (9) | 0 | 0 |
| 音声変調 | 14 (11) | 0 | 0 | 2 (3) | 0 | 0 |
*試験治療を受けなかった1例を除く
- Grade 5の有害事象はレゴラフェニブ群 7例(5%)、プラセボ群 3例(5%)の報告があった。担当医判断で治療関連と考えられたGrade 5の有害事象はレゴラフェニブ群 2例(2%:心停止・肝不全)、プラセボ群 1例(2%:疲労)だった。
- 二重盲検期間における重篤な有害事象はレゴラフェニブ群 38例(29%)、プラセボ群 14例(21%)で報告された。レゴラフェニブ群で一般的な重篤な有害事象は腹痛(n=5, 4%)、発熱(n=3, 2%)、脱水症(n=3, 2%)であり、プラセボ群は疲労(n=2, 3%)、疼痛(n=2, 3%)だった。
- 投与量変更はレゴラフェニブで高率だったが(レゴラフェニブ群 n=95[72%] vs プラセボ群 n=17[26%])、治療中止につながる有害事象の発生は両群でほぼ同等であった(レゴラフェニブ群 n=8[6%] vs プラセボ群 n=5[8%])。
9. 無増悪生存期間に関するサブ解析
- 無増悪生存期間に関して、ベースラインの各因子(治療ライン、地域、性別、年齢、BMI、ECOG PS、イマチニブの治療期間、遺伝子変異)についてサブ解析が行われた。
- イマチニブの治療期間が6ヶ月未満のサブグループでは、6ヶ月以上のサブグループと比較して、レゴラフェニブの効果が減弱する傾向にあったが、それ以外は一貫した有効性を示した。
| N | HR | 95%信頼区間 | |
|---|---|---|---|
| イマチニブ投与期間 6ヶ月未満 6ヶ月以上18ヶ月未満 18ヶ月以上 |
22 33 144 |
0.50 0.19 0.24 |
0.17-1.73 0.07-0.55 0.15-0.36 |
| 遺伝子変異 KIT exon 11変異 KIT exon 9変異 |
51 15 |
0.21 0.24 |
0.10-0.46 0.07-0.88 |
結語
レゴラフェニブは標準治療が無効となった切除不能・転移性GIST患者に対して、無増悪生存期間の有意な延長を示した。
執筆:国立がん研究センター東病院 消化管内科 レジデント 中島 裕理 先生
監修:近畿大学医学部 内科学教室 腫瘍内科部門 医学部講師 川上 尚人 先生
監修:近畿大学医学部 内科学教室 腫瘍内科部門 医学部講師 川上 尚人 先生