| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 膵癌 | 術後補助療法 | 第3相 | 全生存期間 | 国内 | あり |
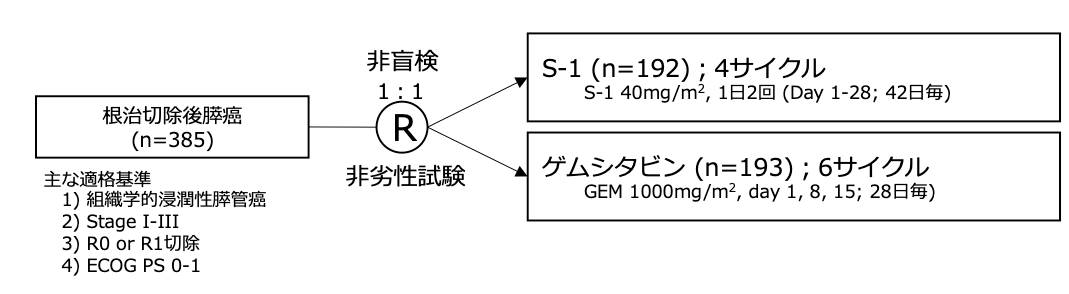
試験名 :JASPAC 01
レジメン:S-1 vs ゲムシタビン(GEM)
登録期間:2007年4月〜2010年6月
背景
根治切除後の膵癌に対して、ゲムシタビンによる術後補助化学療法が標準治療であるが、進行膵癌ではS-1のゲムシタビンに対する非劣性が示されていた。術後補助療法における、S-1のゲムシタビンに対する生存の非劣性を検証するために本試験が行われた。
シェーマ
統計学的事項
主要評価項目:全生存期間
CONKO-01試験に基づき、本試験はゲムシタビン群の3年生存割合を36%と仮定し、S-1群の全生存期間のハザード比が0.87となることを検証する非劣性試験として設計され(非劣性マージン1.25)、検出力80%、片側α=0.025として、360例の登録・240イベントが必要と設定された。試験結果:
- 2007年4月から2010年6月の間に385例が登録され、193例がゲムシタビン群に、192例がS-1群に割り付けられた。
- 割付後に不適格と判明した3例、補助化学療法を受けなかった5例の計8例を除外し、377例をFASとして解析した(ゲムシタビン群 190例、S-1群 187例) 。
- 2012年7月、観察期間中央値 GEM群40.6ヶ月、S-1群 39.2ヶ月の時点で中間解析が行われ、S-1の優越性により、試験の中止が勧告された。2012年9月にプロトコルに基づくすべての治療が中止された。
- 最終フォローアップの2016年1月時点での観察期間中央値は、GEM群 82.3ヶ月、S-1群 79.3ヶ月であった。
- 患者背景に大きな隔たりは認めなかった。
1. 全生存期間(主要評価項目)
| 中央値 | 95%信頼区間 | HR 0.57 (95%C.I. 0.44-0.72) P<0.0001 (非劣性) P<0.0001 (優越性) |
|
| S-1(n=187) | 46.5ヶ月 | 37.8-63.7 | |
| GEM(n=190) | 25.5ヶ月 | 22.5-29.6 |
2. 生存割合
| 3年生存割合 | 95%信頼区間 | 5年生存割合 | 95%信頼区間 | |
|---|---|---|---|---|
| S-1(n=187) | 59.7% | 52.3-66.3 | 44.1% | 36.9-51.1 |
| GEM(n=190) | 38.8% | 31.9-45.7 | 24.4% | 18.6-30.8 |
3. 無再発生存期間
| 中央値 | 95%信頼区間 | HR 0.60 (95%C.I. 0.47-0.76) P<0.0001 |
|
| S-1(n=187) | 22.9ヶ月 | 17.4-30.6 | |
| GEM(n=190) | 11.3ヶ月 | 9.7-13.6 |
4. 無再発生存割合
| 3年無再発生存割合 | 95%信頼区間 | 5年無再発生存割合 | 95%信頼区間 | |
|---|---|---|---|---|
| S-1(n=187) | 39.2% | 32.2-46.2 | 33.3% | 26.7-40.1 |
| GEM(n=190) | 22.6% | 17.0-28.8 | 16.8% | 11.9-22.5 |
5. 有害事象(NCI-CTCAE ver.3.0)
| S-1(n=187) | GEM(n=190) | |||
|---|---|---|---|---|
| 全Grade | Grade 3以上 | 全Grade | Grade 3以上 | |
| 白血球減少 | 104 (56%) | 16 (9%) | 179 (94%) | 74 (39%) |
| 好中球数減少 | 140 (75%) | 25 (13%) | 182 (96%) | 138 (73%) |
| 貧血 | 173 (93%) | 26 (14%) | 188 (99%) | 33 (17%) |
| 血小板数減少 | 80 (43%) | 9 (5%) | 133 (70%) | 18 (9%) |
| 発熱性好中球減少 | 1 (1%) | 1 (1%) | 3 (2%) | 3 (2%) |
| AST上昇 | 117 (63%) | 2 (1%) | 144 (76%) | 10 (5%) |
| ALT上昇 | 104 (56%) | 1 (1%) | 147 (78%) | 8 (4%) |
| 疲労 | 124 (66%) | 10 (5%) | 132 (69%) | 9 (5%) |
| 口内炎 | 75 (40%) | 5 (3%) | 27 (14%) | 0 (0%) |
| 食欲不振 | 120 (64%) | 15 (8%) | 105 (55%) | 11 (6%) |
| 嘔気 | 84 (45%) | 7 (4%) | 99 (52%) | 5 (3%) |
| 嘔吐 | 42 (22%) | 3 (2%) | 47 (25%) | 2 (1%) |
| 下痢 | 88 (47%) | 9 (5%) | 65 (34%) | 0 (0%) |
結語
本試験の結果、本邦においては、膵癌根治切除後に対してS-1による補助化学療法が新たな標準治療となった。
執筆:北海道大学 消化器内科 特任助教 川本 泰之 先生
監修:神奈川県立がんセンター 消化器内科(肝胆膵)部長 上野 誠 先生
監修:神奈川県立がんセンター 消化器内科(肝胆膵)部長 上野 誠 先生