| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 胃癌 | 一次治療 | 第3相 | 全生存期間 | 国内 | あり |
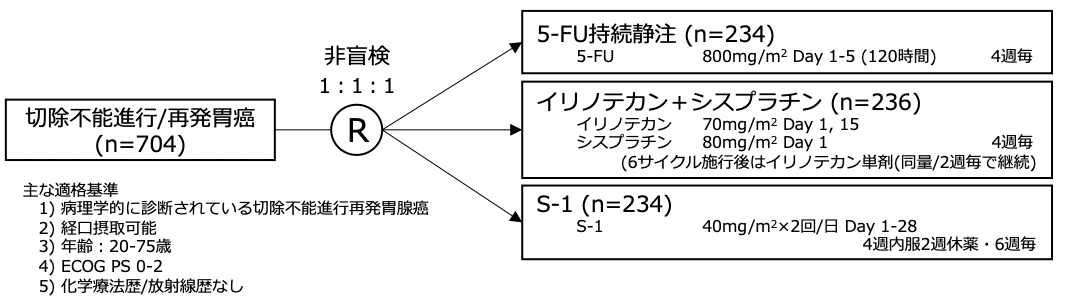
試験名 :JCOG9912
レジメン:5-FU vs イリノテカン+シスプラチン vs S-1
登録期間:2000年11月〜2006年1月
背景
1990年代初頭に胃がんに対し、アントラサイクリン系薬剤、マイトマイシンC、5-FU、メトトレキサートおよびシスプラチンを用いた臨床試験が複数行われたが、標準治療は確立しなかった。3つの第3相試験が報告されたが、5-FU単剤療法に対して5-FU+シスプラチン療法の生存改善は示されなかった。以上より、5-FU持続静注が次の第3相試験の標準治療として結論付けられた。
1990年代後半に胃癌に対して新規薬剤が開発された。イリノテカン+シスプラチン療法は第2相試験において、奏効割合59%および生存期間中央値 322日と良好な成績を認める一方、Grade 4の好中球数減少(57%)やGrade 3-4の下痢(20%)が高頻度に生じたが、減量によって管理可能と考えられた。また、S-1単剤療法も2つの第2相試験の結果が報告され、奏効割合45%、2年生存割合 17%と良好な有効性、かつ、Grade 3-4の治療関連有害事象は5%以下と忍容性も良好であり、外来ベースでの投与が可能であった。
以上をふまえ、標準治療である5ーFU単剤療法に対し、イリノテカン+シスプラチン療法の優越性、およびS-1の非劣性を検証する3アームの第3相試験が企画された。
1990年代後半に胃癌に対して新規薬剤が開発された。イリノテカン+シスプラチン療法は第2相試験において、奏効割合59%および生存期間中央値 322日と良好な成績を認める一方、Grade 4の好中球数減少(57%)やGrade 3-4の下痢(20%)が高頻度に生じたが、減量によって管理可能と考えられた。また、S-1単剤療法も2つの第2相試験の結果が報告され、奏効割合45%、2年生存割合 17%と良好な有効性、かつ、Grade 3-4の治療関連有害事象は5%以下と忍容性も良好であり、外来ベースでの投与が可能であった。
以上をふまえ、標準治療である5ーFU単剤療法に対し、イリノテカン+シスプラチン療法の優越性、およびS-1の非劣性を検証する3アームの第3相試験が企画された。
シェーマ
統計学的事項
主要評価項目:全生存期間
本試験は5-FU持続静注を対照群として、6ヶ月生存割合 50%・1年生存割合 30%と設定した。イリノテカン+シスプラチン群において両者が10%改善すること、およびS-1群の非劣性マージンを5%と設定し(HR 1.16)、検出力70%、片側α=0.05として、450例の登録が必要と設定された。上記の症例集積が完了する頃、全症例の1年生存期間を算出したところ、予想よりも極めて良好であったため、2005年3月に症例数を再計算することとし、検出力80%に変更、690例の登録に変更した。
また、2007年2月には統計学的効率性を向上させるためにHolm’s法に基づいて、まずは二群間の差が最大のものをα=0.025で比較し、もし有意であった場合には、もう1群をα=0.05で検証することとした。またS-1の非劣勢が証明された場合、優越性も検証するデザインとなった。
試験結果:
- 2000年11月から2006年1月の間に704例が登録され、234例が5-FUに、236例がイリノテカン+シスプラチンに、234例がS-1に無作為割り付けされた。
- 患者背景は3群間でバランスがとれていた。
- ECOG PSはほとんどの症例で0-1であった(ECOG PS 0/1/2:5-FU 152/79/3, イリノテカン+シスプラチン 151/81/4, S-1 151/80/3)。
- 各群に1例ずつ、術後補助化学療法歴のある症例が含まれた。
- 全体の約75%(n=531)で標的病変を有していた。
1. 全生存期間 (主要評価項目) (死亡イベント n=601, 85%:2007年3月)
| 中央値 | 四分位範囲 | 5-FU vs イリノテカン+シスプラチン 優越性:HR 0.85 (95%信頼区間 0.70-1.04), p=0.0552 5-FU vs S-1 非劣性:HR 0.83 (95%信頼区間 0.68-1.01), p=0.0005 優越性:p=0.0336;片側α=0.025 |
|
| 5-FU | 10.8ヶ月 | 5.7-17.8 | |
| イリノテカン+シスプラチン | 12.3ヶ月 | 8.1-19.5 | |
| S-1 | 11.4ヶ月 | 6.4-21.3 |
2. 全生存期間 (追加解析) (死亡イベント n=660, 94%:2008年11月)
| 2年生存割合 | 5-FU vs イリノテカン+シスプラチン 優越性:HR 0.82 (95%信頼区間 0.68-0.99), p=0.0194 5-FU vs S-1 非劣性:HR 0.83 (95%信頼区間 0.68-1.00), p=0.0002 優越性:p=0.0233 |
|
| 5-FU | 14% | |
| イリノテカン+シスプラチン | 18% | |
| S-1 | 21% |
3. 全生存期間 (探索的サブ解析:標的病変を有する症例のみ)
| N | 中央値 | 四分位範囲 | 5-FU vs イリノテカン+シスプラチン HR 0.73 (95%信頼区間 0.59-0.91), p=0.0022 5-FU vs S-1 HR 0.84 (95%信頼区間 0.68-1.05), p=0.0590 |
|
| 5-FU | 175 | 9.0ヶ月 | 5.4-15.2 | |
| イリノテカン+シスプラチン | 181 | 12.1ヶ月 | 8.1-19.0 | |
| S-1 | 175 | 10.5ヶ月 | 5.6-19.2 |
4. 全生存期間 (探索的サブ解析:標的病変を有さない症例のみ)
| N | 中央値 | 四分位範囲 | 5-FU vs イリノテカン+シスプラチン HR 1.12 (95%信頼区間 0.76-1.65), p=0.7219 5-FU vs S-1 HR 0.79 (95%信頼区間 0.53-1.16), p=0.1101 |
|
| 5-FU | 59 | 13.5ヶ月 | 7.9-23.4 | |
| イリノテカン+シスプラチン | 55 | 14.4ヶ月 | 9.0-20.7 | |
| S-1 | 59 | 18.1ヶ月 | 10.5-26.6 |
5. 治療成功期間
- 5-FU群とS-1群に割り付けられた症例の約85%は病勢進行により治療中止となったが、イリノテカン+シスプラチン群に割り付けられた症例の3分の1は有害事象で中止となった。
- 二次化学療法への移行:5-FU群 194例(83%)、イリノテカン+シスプラチン群 183例(78%)、S-1群 173例(74%)
- 5-FU群の内、70例がイリノテカン+シスプラチン・20例がS-1、イリノテカン+シスプラチン群の内、127例がS-1・7例が5-FU、S-1群の内、68例がイリノテカン+シスプラチン・2例が5-FUにクロスオーバーした。
| 中央値 | 四分位範囲 | 5-FU vs イリノテカン+シスプラチン HR 0.85 (95%信頼区間 0.71-1.02), p=0.0430 5-FU vs S-1 HR 0.73 (95%信頼区間 0.61-0.88), p=0.0004 |
|
| 5-FU | 2.3ヶ月 | 1.4-5.4 | |
| イリノテカン+シスプラチン | 3.7ヶ月 | 1.9-5.6 | |
| S-1 | 4.0ヶ月 | 2.0-6.3 |
6. 無増悪生存期間
| 中央値 | 四分位範囲 | 5-FU vs イリノテカン+シスプラチン HR 0.69 (95%信頼区間 0.58-0.83), p<0.0001 5-FU vs S-1 HR 0.77 (95%信頼区間 0.64-0.93), p=0.0027 |
|
| 5-FU | 2.9ヶ月 | 1.7-5.7 | |
| イリノテカン+シスプラチン | 4.8ヶ月 | 2.3-8.2 | |
| S-1 | 4.2ヶ月 | 2.2-7.1 |
7. 無増悪生存期間 (標的病変を有する症例のみ)
| 中央値 | 四分位範囲 | 5-FU vs イリノテカン+シスプラチン HR 0.56 (95%信頼区間 0.45-0.69), p<0.0001 5-FU vs S-1 HR 0.80 (95%信頼区間 0.65-0.98), p=0.0174 |
|
| 5-FU | 2.2ヶ月 | 1.4-5.3 | |
| イリノテカン+シスプラチン | 4.8ヶ月 | 2.3-8.1 | |
| S-1 | 3.8ヶ月 | 2.0-5.6 |
8. 奏効割合 (標的病変を有する症例のみ) (RECIST ver.1.0)
| N | 奏効割合 | |
|---|---|---|
| 5-FU | 175 | 9% |
| イリノテカン+シスプラチン | 181 | 38% |
| S-1 | 174 | 28% |
9. 非入院生存期間
| 中央値 | 四分位範囲 | 5-FU vs イリノテカン+シスプラチン HR 0.81 (95%信頼区間 0.67-0.97), p=0.0115 5-FU vs S-1 HR 0.77 (95%信頼区間 0.63-0.92), p=0.0025 |
|
| 5-FU | 7.2ヶ月 | 2.7-13.3 | |
| イリノテカン+シスプラチン | 9.5ヶ月 | 4.9-15.7 | |
| S-1 | 9.3ヶ月 | 4.2-18.0 |
10. 6ヶ月以内に報告された有害事象(Grade 3以上) (NCI-CTC ver.2.0)
| N(%) | 5-FU | イリノテカン+シスプラチン | S-1 |
|---|---|---|---|
| 白血球減少 | 3 (1) | 152 (65) | 13 (6) |
| 貧血 | 36 (16) | 92 (39) | 30 (13) |
| 発熱性好中球減少症 | 0 | 22 (9) | 0 |
| 好中球減少を伴う感染症 | 0 | 18 (8) | 1 (<1) |
| 好中球減少を伴わない感染症 | 9 (4) | 9 (4) | 13 (6) |
| クレアチニン増加 | 0 | 5 (2) | 2 (1) |
| 低ナトリウム血症 | 15 (6) | 53 (23) | 12 (5) |
| 疲労 | 4 (2) | 24 (10) | 12 (5) |
| 食欲不振 | 29 (13) | 77 (33) | 29 (12) |
| 下痢 | 1 (<1) | 21 (9) | 18 (8) |
| 悪心 | 16 (7) | 48 (21) | 13 (6) |
| 治療関連死亡 | 0 | 3 (1) | 1(<1) |
結語
S-1は5-FU持続静注に対して非劣性を示し、経口投与の簡便性の観点から切除不能進行再発胃がんの治療とした5-FU持続静注に置き換えることができると考えられた。一方、イリノテカン+シスプラチンは5-FU持続静注に対する優越性を示せなかった。
本試験では本邦の過去の試験(JGOG9205)と比較し、同じ5-FU持続静注の無増悪生存期間は2ヶ月程度で大きな違いを認めないが、JCOG9205と比較し、本試験で全生存期間中央値が約2ヶ月の延長を示した。本試験では70%以上の症例が二次化学療法を受けており、JCOG9205(53%)より高率に二次化学療法へ移行出来ていた。二次化学療法の有効性は現時点では明らかではないが、本試験の良好な全生存期間に二次化学療法が寄与していたことが示唆された。
本試験では本邦の過去の試験(JGOG9205)と比較し、同じ5-FU持続静注の無増悪生存期間は2ヶ月程度で大きな違いを認めないが、JCOG9205と比較し、本試験で全生存期間中央値が約2ヶ月の延長を示した。本試験では70%以上の症例が二次化学療法を受けており、JCOG9205(53%)より高率に二次化学療法へ移行出来ていた。二次化学療法の有効性は現時点では明らかではないが、本試験の良好な全生存期間に二次化学療法が寄与していたことが示唆された。
執筆:神戸市立医療センター中央市民病院 腫瘍内科 医長 松本 俊彦 先生
監修:北海道大学病院 消化器内科 助教 結城 敏志 先生
監修:北海道大学病院 消化器内科 助教 結城 敏志 先生