| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 胃癌 | 二次/三次治療 | 第3相 | 全生存期間 | 韓国 | なし |
試験名 :なし
レジメン:イリノテカン or ドセタキセル vs BSC
登録期間:2008年9月〜2010年9月
背景
進行胃癌に対する一次化学療法はフッ化ピリミジン+プラチナ製剤の併用療法が標準治療として広く認識されているが、半数以上は奏効が得られず、奏効が得られても奏効期間は数ヶ月と短い。
本試験の立案時点において、進行胃癌において一次治療に引き続くサルベージ化学療法(SLC)が生存期間を延長するというエビデンスは存在しておらず、いくつかの第2相試験では良好な結果が得られていたが、日常臨床には一般化されていなかった。
以上の背景より、フッ化ピリミジン/プラチナ製剤投与後の進行胃癌患者を対象に、ベストサポーティブケア(BSC)に対するSLC(イリノテカン or ドセタキセル)の有効性/安全性を検証する目的に本試験が計画された。
本試験の立案時点において、進行胃癌において一次治療に引き続くサルベージ化学療法(SLC)が生存期間を延長するというエビデンスは存在しておらず、いくつかの第2相試験では良好な結果が得られていたが、日常臨床には一般化されていなかった。
以上の背景より、フッ化ピリミジン/プラチナ製剤投与後の進行胃癌患者を対象に、ベストサポーティブケア(BSC)に対するSLC(イリノテカン or ドセタキセル)の有効性/安全性を検証する目的に本試験が計画された。
シェーマ
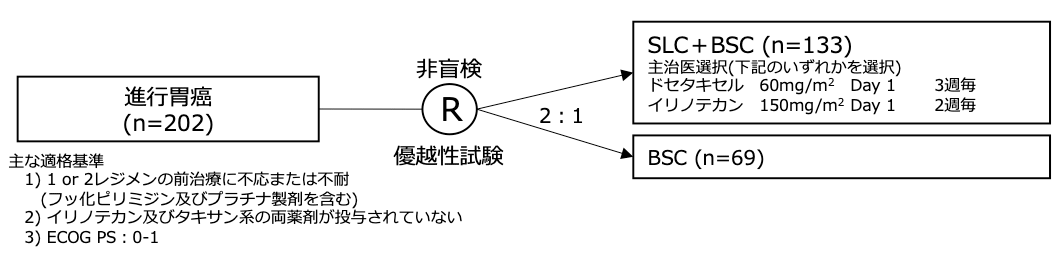
統計学的事項
主要評価項目:全生存期間
過去の後方視的検討よりBSCの生存期間中央値を4ヶ月と設定し、SLCにより死亡に対するハザード比が43%減少すると設定した。SLC+BSC群 : BSC群=2 : 1の患者割付、片側α=0.025、検出力90%、15例/月の登録、24ヶ月以内の登録期間を設定し、201例の登録と134イベントが必要と設定した。試験結果:
- 本試験は2008年9月に韓国国内8施設で登録を開始した。ドイツから同様の試験結果が報告されたことを受けて2009年12月から2010年2月まで一時的に登録が中断されたが、試験登録継続を決定し、202例まで登録を継続した(最終登録:2010年9月)。
- 9例(SLC+BSC群 5例/BSC群 4例)が不適格であった:前治療がフッ化ピリミジン単剤(n=3)、ECOG PS 2(n=2)、3レジメン以上の前治療歴(n=4)
- 5例が実際に割り付けられた治療を受けず(SLC+BSC群の2例:化学療法を辞退、BSC群の1例:早期死亡、BSC群の2例:実際には化学療法を受けた)、188例(SLC+BSC群 126例/BSC群 62例)が試験プロトコールに従った治療を受けた。
- データカットオフは2011年7月であり、観察期間中央値は20ヶ月であった。
1. 患者背景
- 患者背景は両群間でバランスがとれていた。
- 前治療からの休薬期間中央値は、SLC+BSC群 42日、BSC群 39日であった。
- 一次治療レジメンはフッ化ピリミジン+シスプラチン±エピルビシンが68%と最多であり、オキサリプラチンベースの治療は26%であった。
- ドセタキセル/イリノテカンを含む一次治療を受けたのはそれぞれ3%/2%であった。
- 54例が二次治療を受けており、その内訳はフッ化ピリミジン単剤 65%、シスプラチン or オキサリプラチン+フッ化ピリミジン 18%、ドセタキセル 9%、イリノテカン 8%であった。
- SLC+BSC群に登録された症例のうち、ドセタキセルが選択されたのが66例、イリノテカンが選択されたのが60例であった。
2. 全生存期間(主要評価項目)
| n | 中央値 | 95%信頼区間 | HR 0.657 (95%C.I. 0.485-0.891) p=0.007 (片側) |
|
| SLC+BSC | 133 | 5.3ヶ月 | 4.1-6.5 | |
| BSC | 69 | 3.8ヶ月 | 3.1-4.5 |
3. レジメン別の全生存期間(探索的解析)
| n | 中央値 | 95%信頼区間 | p=0.116(両側) | |
| ドセタキセル | 66 | 5.2ヶ月 | 3.8-6.6 | |
| イリノテカン | 60 | 6.5ヶ月 | 4.5-8.5 |
- BSC群との比較ではドセタキセル HR 0.760 (95%信頼区間 0.533-1.085)、イリノテカン HR 0.582 (95%信頼区間 0.398-0.848)であった。
4. レジメン別の奏効割合/病勢制御割合
- 測定可能病変を有する症例:ドセタキセル 42例、イリノテカン 50例
| n | 奏効割合 | 病勢制御割合 | |
|---|---|---|---|
| ドセタキセル | 42 | 16.7% | 59.5% |
| イリノテカン | 50 | 10.0% | 52.0% |
5. レジメン別の治療期間
| n | 中央値 | 95%信頼区間 | |
|---|---|---|---|
| ドセタキセル | 66 | 4.4ヶ月 | 3.8-4.9 |
| イリノテカン | 60 | 4.2ヶ月 | 3.4-5.0 |
6. 全生存期間に対する単変量解析/多変量解析
| HR | 95%信頼区間 | P値 | ||
|---|---|---|---|---|
| 年齢 | 中央値(56歳)以下 中央値を超える |
1 1.063 |
0.789-1.433 |
0.686 |
| 性別 | 男性 女性 |
1 0.831 |
0.599-1.152 |
0.267 |
| 前治療レジメン数 | 1 2 |
1 2.044 |
1.440-2.901 |
<0.001 |
| 手術歴 | なし あり |
1 0.862 |
0.350-2.000 |
0.736 |
| 前治療の奏効 | なし あり |
1 0.784 |
0.576-1.068 |
0.123 |
| ECOG PS | 0 1 |
1 2.022 |
1.494-2.736 |
<0.001 |
| 開始時のヘモグロビン | 平均(11.6g/dL)以下 平均を超える |
1 0.969 |
0.718-1.309 |
0.839 |
| 測定可能病変 | なし あり |
1 0.770 |
0.562-1.054 |
0.102 |
| 転移臓器個数 | 1 2以上 |
1 1.239 |
0.911-1.686 |
0.173 |
| 最終治療からの期間 | 3ヶ月未満 3ヶ月以上 |
1 0.682 |
0.483-0.964 |
0.030 |
- 単変量解析による全生存期間に有意に寄与する因子は、治療群の他に、前治療レジメン数、ECOG PS、最終治療からの期間の3因子が抽出された。
- 多変量解析では単変量解析の結果と同様の結果を示した。
- ECOG PS :0 vs 1, HR 2.035, 95%信頼区間 1.493-2.775, p<0.001
- 最終治療からの期間:3ヶ月未満 vs 以上, HR 0.638, 95%信頼区間 0.448-0.910, p=0.013
- 前治療レジメン数:1 vs 2, HR 1.811, 95%信頼区間 1.266-2.589, p=0.001
- これらの3因子で調整後もSLC+BSCは有意に死亡リスクを軽減した(HR 0.711, 95%信頼区間 0.536-0.974, p=0.017)。
7. 各臨床背景毎のサブ解析(全生存期間)
| n | HR | 95%信頼区間 | ||
|---|---|---|---|---|
| 年齢 | 56歳未満 56歳以上 |
99 103 |
0.713 0.572 |
0.459-1.109 0.371-0.881 |
| 性別 | 男性 女性 |
137 65 |
0.601 0.672 |
0.414-0.870 0.384-1.174 |
| 前治療レジメン数 | 1 2 |
148 54 |
0.617 0.812 |
0.430-0.887 0.450-1.464 |
| 前治療の奏効 | なし あり |
119 83 |
0.809 0.480 |
0.535-1.222 0.297-0.776 |
| ECOG PS | 0 1 |
108 94 |
0.587 0.717 |
0.383-0.898 0.457-1.126 |
| 開始時のヘモグロビン | 12g/dL未満 12g/dL以上 |
106 96 |
0.755 0.530 |
0.488-1.167 0.338-0.826 |
| 測定可能病変 | なし あり |
63 139 |
0.361 0.768 |
0.196-0.668 0.528-1.120 |
| 転移臓器個数 | 1 2以上 |
70 132 |
0.554 0.630 |
0.332-0.924 0.422-0.939 |
| 最終治療からの期間 | 3ヶ月未満 3ヶ月以上 |
149 53 |
0.606 0.707 |
0.423-0.867 0.382-1.307 |
| 全症例 | 202 | 0.657 | 0.485-0.891 |
- いずれの因子においてもSLC+BSC群の有用性が維持された。
8. 投与状況
- 相対用量強度中央値:ドセタキセル 95%/イリノテカン 93%
- 主な治療中止理由:病勢進行 62%、患者拒否 15%、有害事象 13%、試験治療外の治療実施や死亡を含むその他の理由 10%
- SLC+BSC群では病勢進行による治療中止例が、BSC群では患者拒否による治療中止例が多く、両群間で治療中止理由は異なっていた。
9. 有害事象(CTCAE ver3.0)
| N(%) | ドセタキセル (n=66) |
イリノテカン (n=60) |
BSC (n=62) |
|||
|---|---|---|---|---|---|---|
| 全Grade | ≦Grade 3 | 全Grade | ≦Grade 3 | 全Grade | ≦Grade 3 | |
| 好中球数減少 | 41 (62) | 10 (15) | 35 (58) | 11 (18) | 8 (13) | 1 (2) |
| 貧血 | 50 (76) | 20 (30) | 46 (77) | 19 (32) | 38 (61) | 14 (23) |
| 血小板数減少 | 16 (24) | 1 (2) | 13 (22) | 2 (3) | 3 (5) | 0 (0) |
| 疲労 | 25 (38) | 17 (26) | 13 (22) | 6 (10) | 25 (40) | 17 (27) |
| 食欲不振 | 11 (17) | 4 (6) | 20 (33) | 3 (5) | 29 (47) | 6 (10) |
| 悪心 | 14 (21) | 3 (5) | 19 (32) | 2 (3) | 20 (32) | 4 (6) |
| 下痢 | 9 (14) | 2 (3) | 9 (15) | 5 (8) | 11 (18) | 3 (5) |
| 口腔粘膜炎 | 10 (15) | 2 (3) | 11 (18) | 3 (5) | 3 (5) | 1 (2) |
- 無作為割り付け後、30日以内の死亡(死因問わず)は両群ともに2%であった。
10. 後治療
| 移行割合 | p=0.011 | |
| SLC+BSC | 40% | |
| BSC | 22% |
- 後治療の最多は治験薬であった(52例, 77%)。
- BSC群の1例/3例がそれぞれドセタキセル/イリノテカンの投与を受けた。
- 割り付け群にかかわらず、後治療を受けた症例は未施行の症例と比較し、有意に生存延長を示した(8.0ヶ月 vs 3.7ヶ月, p<0.001)。
結語
本試験の結果より、進行胃癌患者に対するドセタキセルまたはイリノテカンによるSLCは良好な認容性を示し、BSC単独に比べて有意に全生存期間を延長することが示された。
執筆:北海道大学病院 消化器内科 特任助教 原田 一顕 先生
監修:北海道大学病院 消化器内科 助教 結城 敏志 先生
監修:北海道大学病院 消化器内科 助教 結城 敏志 先生