| 対象疾患 | 治療ライン | 研究の相 | 評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 胃癌/食道胃接合部癌 | 一次治療 | 第3相 | 全生存期間 | 日本・韓国 | あり |
試験名 :START, JACCRO GC-03
レジメン:S-1+ドセタキセル vs S-1
登録期間:2005年9月〜2008年9月
背景
1990年代後半には、シスプラチン+5-FU併用療法は進行胃癌に対する標準治療として世界的に受け入れられ、新たな化学療法レジメン開発のための多くの無作為化比較試験で採用されてきた。しかし、シスプラチン(CDDP)は高頻度の悪心・嘔吐、腎機能障害、投与に入院を要する、患者のQOLを下げるその他の有害事象のように、いくつかの重要な欠点を持っており、腎機能低下例には投与禁忌となっている。したがって、プラチナ製剤を含まない化学療法レジメンの開発は、進行胃癌の一次治療の新しい選択肢として待望されていた。
本試験の計画の間、ドセタキセル(DOC)およびS-1(テガフール[5-FUのプロドラッグ]とギメラシル及びオテラシルカリウムを1:0.4:1のモル比で配合した経口製剤)が進行胃癌に対して、単剤療法として有効性を示した。西欧諸国では、進行胃癌患者を対象に、DOC+CDDP+5-FU併用療法とCDDP+5-FU併用療法を比較した第3相試験が進行中であった(V325試験)。日本では、S-1が進行胃癌の治療薬として最も広く使用されており、S-1単剤療法とS-1+CDDP併用療法を比較した第3相試験(SPIRITS試験)、およびS-1単剤療法とS-1とイリノテカン(CPT-11)併用療法を比較したTOP-002試験が進行中であった。
日本人の進行胃癌患者を対象としたS-1+DOC併用療法の第2相試験と第1/2相試験では、奏効割合 56.2/45.7%。生存期間中央値 14.3/14.0ヶ月と報告されている。DOCの用量(40 mg/m2)は西欧諸国で使用されている用量よりも低かったが、いずれの研究でもS-1+DOC併用療法は良好な忍容性を示し、進行胃癌に対する有望な新治療であることを示唆していた。これらの結果を検証するために、進行胃癌に対するプラチナ製剤を使用しない一次治療として、S-1+DOC併用療法とS-1単剤療法と比較検討する本試験を開始した。
本試験の計画の間、ドセタキセル(DOC)およびS-1(テガフール[5-FUのプロドラッグ]とギメラシル及びオテラシルカリウムを1:0.4:1のモル比で配合した経口製剤)が進行胃癌に対して、単剤療法として有効性を示した。西欧諸国では、進行胃癌患者を対象に、DOC+CDDP+5-FU併用療法とCDDP+5-FU併用療法を比較した第3相試験が進行中であった(V325試験)。日本では、S-1が進行胃癌の治療薬として最も広く使用されており、S-1単剤療法とS-1+CDDP併用療法を比較した第3相試験(SPIRITS試験)、およびS-1単剤療法とS-1とイリノテカン(CPT-11)併用療法を比較したTOP-002試験が進行中であった。
日本人の進行胃癌患者を対象としたS-1+DOC併用療法の第2相試験と第1/2相試験では、奏効割合 56.2/45.7%。生存期間中央値 14.3/14.0ヶ月と報告されている。DOCの用量(40 mg/m2)は西欧諸国で使用されている用量よりも低かったが、いずれの研究でもS-1+DOC併用療法は良好な忍容性を示し、進行胃癌に対する有望な新治療であることを示唆していた。これらの結果を検証するために、進行胃癌に対するプラチナ製剤を使用しない一次治療として、S-1+DOC併用療法とS-1単剤療法と比較検討する本試験を開始した。
シェーマ
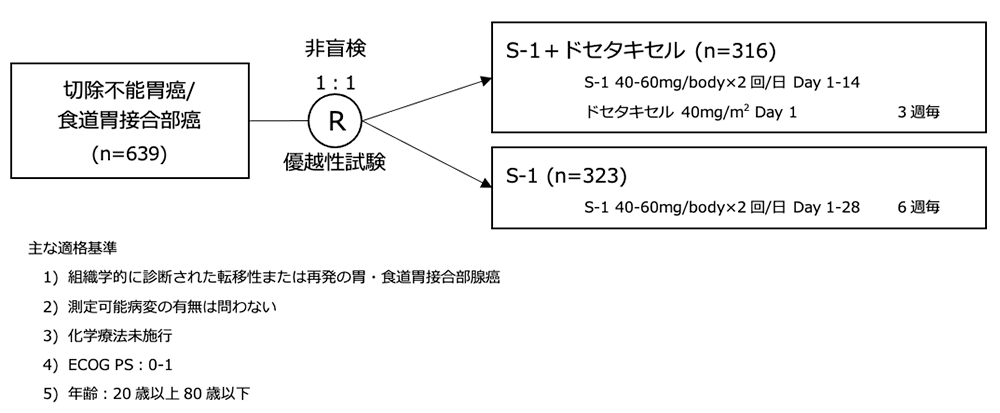
統計学的事項
主要評価項目:全生存期間
過去に実施された二つの第2相試験において、S-1単剤治療の生存期間中央値は250日と207日と報告されている。一方、二つのS-1+DOCの生存期間中央値は434日と427日と報告された。これらの結果から、S-1+ドセタキセル併用療法の生存期間を400日、S-1単剤療法の生存期間300日と想定した。検出力を90%、両側α=0.05、登録期間3年、追跡期間2年、10%の脱落を考慮して628例の症例が必要と設定された。377の死亡イベントが観察された時点で、試験継続可否を判定するための中間解析を計画した。試験結果:
- 2005年9月から2008年9月の間に日本 97施設、韓国 16施設から639例が登録され、S-1+DOC群に316例、S-1群に323例が無作為割り付けされた。
- RECIST v1.0における評価可能病変(測定可能/測定不能病変のいずれも)を持たない4例(各群 2例)が不適格となり、intent-to-treat(ITT)解析には635例が含まれた(S-1+DOC群 314例、S-1群 321例)。
- ITT集団の追跡期間中央値:11.4ヶ月(四分位範囲 6.21-21.2)
1. 患者背景
| N | S-1+DOC群 (N=314) | S-1群 (N=321) | p値 | |
|---|---|---|---|---|
| 性別 | 男性 女性 |
227 87 |
229 92 |
0.79 |
| 年齢 | 中央値 (範囲) | 65 (23-79) | 65 (27-79) | 0.66 |
| ECOG PS | 0 1 |
137 177 |
147 174 |
0.58 |
| 原発巣 | なし あり |
168 146 |
163 158 |
0.49 |
| 測定可能病変 | なし あり |
72 242 |
72 249 |
0.88 |
| 診断 | 進行 再発 |
260 54 |
267 54 |
0.90 |
| 術後補助化学療法 | なし あり |
292 22 |
297 24 |
0.82 |
| 転移臓器個数 | 1 2 3以上 |
96 116 102 |
87 115 119 |
0.43 |
| 転移臓器 | リンパ節 肝 肺 骨 腹膜 |
215 108 19 9 119 |
225 107 28 12 131 |
0.66 0.78 0.20 0.54 0.45 |
- 患者背景は両群間でバランスが取れていた。
2. 全生存期間 (主要評価項目)
| N | 中央値 | 95%信頼区間 | 1年生存割合 | 2年生存割合 | 3年生存割合 | |
|---|---|---|---|---|---|---|
| S-1+DOC群 | 314 | 12.5ヶ月 | 11.4-14.8 | 51.7% | 22.9% | 13.0% |
| S-1群 | 321 | 10.8ヶ月 | 9.5-11.8 | 43.7% | 18.9% | 9.0% |
HR 0.84 (95%信頼区間 0.71-0.99), p=0.032
- 全635例中、582例が死亡、36例が生存、17例が追跡不能であった。
3. 無増悪生存期間
| N | 中央値 | 95%信頼区間 | |
|---|---|---|---|
| S-1+DOC群 | 314 | 5.3ヶ月 | 4.5-5.9 |
| S-1群 | 321 | 4.2ヶ月 | 3.7-4.7 |
HR 0.77 (95%信頼区間 0.65-0.90), p<0.001
4. 奏効割合
| S-1+DOC群 (N=237) | S-1群 (N=243) | p値 | |
|---|---|---|---|
| CR PR |
3 89 |
5 60 |
― |
| 奏効割合 (95%信頼区間) |
38.8% (32.8-45.2) |
26.8% (21.6-32.6 |
0.005 |
- 奏効割合はITT集団から未投与例などを除外したper-protocol set (PPS)を対象とし、PPS集団(621例)の内、測定可能病変を有する480例(77.3%)が解析対象となった。
5. 全生存期間におけるサブグループ解析
| N | HR (95%信頼区間) | ||
|---|---|---|---|
| 国 | 日本 韓国 |
425 210 |
0.810 (0.664-0.987) 0.900 (0.675-1.200) |
| 性別 | 男性 女性 |
456 179 |
0.833 (0.687-1.009) 0.844 (0.620-1.149) |
| 年齢 | 65歳未満 65歳以上 |
304 331 |
0.846 (0.667-1.073) 0.828 (0.661-1.036) |
| ECOG PS | 0 1 |
284 351 |
0.780 (0.611-0.995) 0.882 (0.708-1.098) |
| 診断 | 進行 再発 |
527 108 |
0.840 (0.704-1.004) 0.823 (0.545-1.245) |
| 標的病変 | 測定不能 測定可能 |
144 491 |
0.649 (0.461-0.914) 0.904 (0.751-1.088) |
| 原発巣 | なし あり |
331 304 |
0.846 (0.672-1.063) 0.830 (0.658-1.047) |
| 肝転移 | なし あり |
420 215 |
0.841 (0.687-1.029) 0.816 (0.619-1.077) |
| リンパ節転移 | なし あり |
195 440 |
0.688 (0.512-0.925) 0.928 (0.763-1.129) |
| 腹膜播種 | なし あり |
385 250 |
0.839 (0.679-1.037) 0.861 (0.666-1.112) |
| 転移臓器個数 | 1 2 3以上 |
183 231 221 |
0.814 (0.597-1.109) 0.785 (0.597-1.032) 0.949 (0.724-1.243) |
| 全体 | 635 | 0.837 (0.711-0.985) |
- サブグループ解析では、ECOG PS 0(vs 1)、標的病変が測定不能(vs 測定可能)、リンパ節転移がない(vs あり)、日本人(vs 韓国人)において、S-1+DOC療法がS-1単剤療法と比較し、有意に生存期間の延長を示した。
6. 測定可能病変の有無による生存期間の解析
① 測定可能病変あり
| S-1+DOC群 (N=242) | S-1群 (N=249) | HR | 95%信頼区間 | p値 | |
|---|---|---|---|---|---|
| 全生存期間 | 11.7ヶ月 | 10.3ヶ月 | 0.904 | 0.751-1.088 | 0.2849 |
| 無増悪生存期間 | 4.7ヶ月 | 3.9ヶ月 | 0.822 | 0.686-0.985 | 0.0324 |
② 測定可能病変なし
| S-1+DOC群 (N=72) | S-1群 (N=79) | HR | 95%信頼区間 | p値 | |
|---|---|---|---|---|---|
| 全生存期間 | 17.9ヶ月 | 12.0ヶ月 | 0.649 | 0.461-0.914 | 0.0127 |
| 無増悪生存期間 | 8.4ヶ月 | 5.6ヶ月 | 0.613 | 0.435-0.862 | 0.0045 |
7. 投与状況
- 相対用量強度の中央値:S-1+DOC群でS-1 76.0%・ドセタキセル 80.4%であり、S-1群でS-1 76.2%であった。
- 投与延期を要した症例:S-1+DOC群 14.5%、S-1群 4.2%。主な延期理由は両群ともに有害事象であった。
- 治療中止:主な治療中止理由は両群ともに病勢進行であった。
8. 後治療
- プロトコール治療後の二次治療はS-1+ドセタキセル群で69.7%、S-1群で76.0%に実施された。
- 二次治療が行われた日本人においては79%の症例がCPT-11、CDDP、タキサン系薬剤が実施されており、一方、韓国人においては60%の症例が5-FUをベースとした治療が実施されていた。
9. Grade 3以上の有害事象 (CTCAE v3.0)
| N (%) | S-1+DOC群 (n=310) | S-1 群 (n=313) | p値 |
|---|---|---|---|
| いずれかの事象 | 180 (58.1) | 124 (39.6) | <0.0001 |
| 白血球 | 68 (21.9) | 8 (2.6) | <0.0001 |
| 好中球 | 90 (29.0) | 14 (4.5) | <0.0001 |
| 血小板 | 5 (1.6) | 2 (0.6) | 0.249 |
| ヘモグロビン | 36 (11.6) | 25 (8.0) | 0.128 |
| AST | 3 (1.0) | 7 (2.2) | 0.208 |
| ALT | 3 (1.0) | 6 (1.9) | 0.321 |
| ビリルビン | 4 (1.3) | 8 (2.6) | 0.251 |
| クレアチニン | 1 (0.3) | 2 (0.6) | 0.568 |
| 悪心 | 18 (5.8) | 11 (3.5) | 0.175 |
| 嘔吐 | 10 (3.2) | 7 (2.2) | 0.449 |
| 下痢 | 9 (2.9) | 15 (4.8) | 0.221 |
| 口内炎 | 13 (4.2) | 5 (1.6) | 0.053 |
| 食欲不振 | 48 (15.5) | 37 (11.8) | 0.183 |
| 疲労 | 18 (5.8) | 15 (4.8) | 0.572 |
| 皮疹 | 3 (1.0) | 6 (1.9) | 0.321 |
| 発熱性好中球減少 | 9 (2.9) | 0 (0) | 0.0024 |
- S-1+DOC群で2名の治療関連死亡を認めた(0.6%)。
結語
S-1+DOC併用療法は、特に腎機能障害を有する症例や外来治療を希望する進行胃癌患者に対する一次化学療法として、重要なオプションとして期待される。
執筆:愛知県がんセンター病院 薬物療法部 レジデント 緒方 貴次 先生
監修:岐阜大学医学部付属病院 がんセンター 副センター長/准教授 牧山 明資 先生
監修:岐阜大学医学部付属病院 がんセンター 副センター長/准教授 牧山 明資 先生