| 対象疾患 | 治療ライン | 研究の相 | 評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| HER2陽性 胃癌/食道胃接合部癌 |
一次治療 | 第2相 | 奏効割合 | 国内 | あり |
試験名 :WJOG7212G
レジメン:S-1+シスプラチン(5週毎)+トラスツズマブ併用療法
登録期間:2012年8月〜2014年1月
背景
トラスツズマブ(T-mab)はHER2シグナル伝達を阻害し、抗体依存性細胞傷害を誘発するヒト化モノクローナル抗体である。HER2陽性胃癌/食道胃接合部癌を対象としたToGA試験では、フッ化ピリミジン+シスプラチン(CDDP)が2008年以来、進行胃/食道胃接合部癌に対して最も汎用されている一次化学療法であり、安全性も許容可能で、東アジアで広く用いられている。しかし、5週サイクルのSP+T-mab併用療法の有効性と安全性は評価されておらず、安全性と有効性を評価する目的に多施設共同第2相試験を実施した。
乳癌に対する基礎研究/臨床研究ではT-mabの有効性と耐性に関連するバイオマーカー研究が行われているがT-mab投与中のHER2陽性進行胃/食道胃接合部癌に対するバイオマーカー研究はほとんど報告されていない。残念ながら2つの抗HER2薬(ラパチニブ(LAP)・トラスツズマブエムタンシン(T-DM1))はHER2陽性進行胃/食道胃接合部癌に対して有効性を示せず、これらの結果は乳癌と胃癌の間に生物学的な違いが存在している可能性を示唆している。よって、進行胃/食道胃接合部癌におけるT-mabの感受性・耐性に関連するバイオマーカーを探索するために7つの血清マーカー(HER2細胞外ドメイン、組織メタロプロテアーゼ阻害物質1[TIMP-1]、ニューレグリン1[NRG1]、上皮成長因子[EGF]、腫瘍細胞増殖因子-α[TGF-α]、肝細胞増殖因子[HGF]、インスリン様成長因子1[IGF1])を治療開始前と治療後の連続変化を測定した。
乳癌に対する基礎研究/臨床研究ではT-mabの有効性と耐性に関連するバイオマーカー研究が行われているがT-mab投与中のHER2陽性進行胃/食道胃接合部癌に対するバイオマーカー研究はほとんど報告されていない。残念ながら2つの抗HER2薬(ラパチニブ(LAP)・トラスツズマブエムタンシン(T-DM1))はHER2陽性進行胃/食道胃接合部癌に対して有効性を示せず、これらの結果は乳癌と胃癌の間に生物学的な違いが存在している可能性を示唆している。よって、進行胃/食道胃接合部癌におけるT-mabの感受性・耐性に関連するバイオマーカーを探索するために7つの血清マーカー(HER2細胞外ドメイン、組織メタロプロテアーゼ阻害物質1[TIMP-1]、ニューレグリン1[NRG1]、上皮成長因子[EGF]、腫瘍細胞増殖因子-α[TGF-α]、肝細胞増殖因子[HGF]、インスリン様成長因子1[IGF1])を治療開始前と治療後の連続変化を測定した。
シェーマ
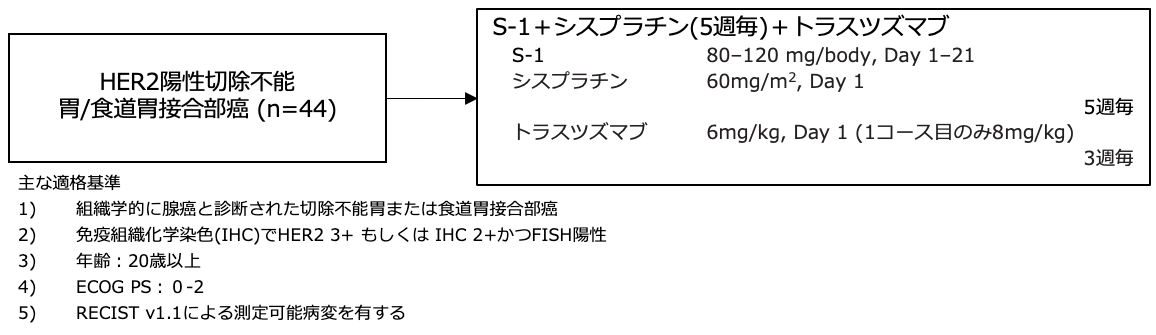
統計学的事項
主要評価項目:奏効割合
主要評価項目はFull analysis set (FAS:登録後不適格が判明した症例を除いた症例)を対象とした独立評価委員会による奏効割合と設定された。閾値奏効割合を40%、期待奏効割合を60%と設定し、片側α=0.1、検出力 80%で設定したところ必要症例数は35例と算出された。症例集積が良好であったことから、試験途中でプロトコル改訂を行い、片側α=0.05、検出力 85%に変更し、必要症例数は55例と算出された。
試験結果:
- 2012年8月から2014年1月までに、日本全国21施設より44例が登録され、全例がFAS、Safety analysis set (SAS:薬剤投与が行われた症例)に組み込まれた。4例は独立評価委員会において測定可能病変がないと判断され、Per protocol set (PPS:何らかの理由で有効性の評価ができなかった症例、投与量やスケジュール、禁止された併用療法などで逸脱/違反のある症例をFASから除いた症例)から除外された。
- 本解析のデータカットオフは2014年12月であり、観察期間中央値は19.3ヶ月(範囲:4.3-24.7ヶ月)であった。
1. 患者背景 (FAS)
| N (%) | N=44 | |
|---|---|---|
| 年齢 (歳) | 中央値 範囲 |
64.5 31-77 |
| 性別 | 男性 女性 |
34 (77.3) 10 (22.7) |
| ECOG PS | 0 1 2 |
30 (68.2) 12 (27.3) 2 (4.5) |
| 原発部位 | 胃 食道胃接合部 |
37 (84.1) 7 (15.9) |
| 転移臓器個数 | 0-1 2以上 |
24 (54.5) 20 (45.5) |
| 転移臓器 | 肝 肺 遠隔リンパ節 腹膜 骨 |
19 (43.2) 7 (15.9) 24 (54.5) 14 (31.8) 2 (4.5) |
| 組織型 | 乳頭腺癌 管状腺癌 低分化腺癌 印環細胞癌 |
3 (6.8) 20 (45.5) 16 (36.4) 2 (4.5) |
| 前治療 | 手術 術後補助化学療法 |
6 (13.6) 1 (2.3) |
| 疾患状態 | 切除不能進行例 再発例 |
43 (97.7) 1 (2.3) |
| HER2 status | IHC 2+ かつ FISH陽性 IHC 3+ |
12 (27.3) 32 (72.7) |
2. 奏効割合(主要評価項目)
- 主要評価項目であるFASを対象とした独立評価委員会による奏効割合は61.4%(95%信頼区間:45.5-75.6%、片側p=0.001)であった。
| N (%) | FAS (n=44) | PPS (n=40) | ||
|---|---|---|---|---|
| 独立評価委員会判定 | 主治医判定 | 独立評価委員会判定 | 主治医判定 | |
| CR PR SD PD NE |
2 (4.5) 25 (56.8) 9 (20.5) 4 (9.1) 4 (9.1) |
2 (4.5) 23 (52.3) 13 (29.5) 4 (9.1) 2 (4.5) |
2 (5.0) 25 (62.5) 9 (22.5) 4 (10.0) 0 (0.0) |
2 (5.0) 22 (55.0) 11 (27.5) 4 (10.0) 1 (2.5) |
| 奏効割合 (95%信頼区間) |
27 (61.4) (45.5-75.6) |
25 (56.8) (42.2-70.3) |
27 (67.5) (50.9-81.4) |
24 (60.0) (44.6-73.7) |
| 病勢制御割合 | 36 (81.8) | 38 (86.4) | 36 (90.0) | 35 (87.5) |
3. 無増悪生存期間
| N | 中央値 | (95%信頼区間) |
|---|---|---|
| 44 | 5.9ヶ月 | (5.0-9.3) |
4. 全生存期間
| N | 中央値 | (95%信頼区間) |
|---|---|---|
| 44 | 16.5ヶ月 | (14.3-21.6) |
5. 有害事象 (CTCAE v4.0, SAS n=44)
| N (%) | 全Grade | Grade 3-4 |
|---|---|---|
| 血液学的有害事象 好中球数減少 貧血 血小板数減少 発熱性好中球減少症 |
29 (65.9) 38 (86.4) 16 (36.4) 2 (4.5) |
13 (29.5) 8 (18.2) 5 (11.4) 2 (4.5) |
| 消化器有害事象 悪心 嘔吐 下痢 口腔粘膜炎 |
27 (61.4) 11 (25.0) 22 (50.0) 20 (45.5) |
5 (11.4) 1 (2.3) 5 (11.4) 2 (4.5) |
| その他の有害事象 食欲不振 疲労 手掌・足底発赤知覚不全症候群 斑状丘疹状皮疹 発熱 AST増加 ALT増加 血中ビリルビン増加 クレアチニン増加 低アルブミン血症 |
36 (81.8) 33 (75.0) 8 (18.2) 6 (13.6) 14 (31.8) 21 (47.7) 16 (36.4) 9 (20.5) 11 (25.0) 26 (59.1) |
11 (25.0) 6 (13.6) 0 (0.0) 0 (0.0) 0 (0.0) 3 (6.8) 4 (9.1) 0 (0.0) 0 (0.0) 5 (11.4) |
- 試験治療中に1名の突然死を認めた。正確な死因は特定できなかったが、治療関連死亡と判断された。
6. 投与状況
- 各薬剤の投与サイクル中央値(範囲):S-1 5.0サイクル(1.0-17.0)、CDDP 5.0サイクル(0-8.0)、T-mab 8.5サイクル(1.0-29.0)
- 5例はデータカットオフ時点でプロトコール治療を継続していた。
- プロトコール治療を中止した39例の中止理由:病勢進行(n=27, 61.4%)、有害事象に起因する患者希望(n=4, 9.1%:食欲不振 n=1, 疲労 n=1, 不明 n=2)、根治切除への移行(n=3, 6.8%)、Grade 4の敗血症(n=1, 2.3%)、試験治療中の死亡(n=1, 2.3%)、個人的理由での患者希望(n=1, 2.3%)、完全奏効の達成(n=1, 2.3%)、有害事象による担当医判断(n=1, 2.3%)
- プロトコール治療中、T-mabを中止した症例はいなかった。
- 3例はS-1+CDDP併用療法を中止し、プロトコール治療としてT-mabのみを継続した。1例はCDDPを中止し、プロトコール治療としてS-1+T-mabを継続した。
7. 後治療
- プロトコール治療を中止した39例中、32例(82.1%)が二次化学療法を受けた。
- タキサンベースのレジメンが二次化学療法として最も頻用された(n=18)。
- 40%以上の症例で病勢進行後もT-mab併用レジメン(n=16)、またはT-DM1 (n=3)の投与を受けた。
8. 血清バイオマーカー解析
- 血清サンプルは44例中、31例(70.5%)で利用可能であった。この31例の患者背景は全体集団と近似していた。
- 各時点で収集された血清サンプル数は、治療開始前 n=31、2回目のT-mab投与前 n=31、4回目のT-mab投与前 n=28、増悪確認後 n=18であった。
- 治療開始前と比較し、HER2(2投前 p=0.037)、NRG1(2投前 p=0.026、4投前 p=0.022)、EGF(2投前 p<0.001、4投前 p<0.001、増悪確認後 p=0.004)は治療後に有意に低下したが、残りのバイオマーカーは治療開始前から有意な変化を示さなかった。また、増悪確認後に有意に上昇するバイオマーカーはなかった。
- HER2およびNRG1は非奏効例(n=10)よりも奏効例(n=21)で有意に高値であった(平均±標準誤差:HER2 96±68 vs 12±2 ng/mL, p=0.026、NRG1 2490±883 vs 242±180 pg/mL, p=0.012)。
- 高マーカー群と低マーカー群は、それぞれ治療開始前の値の中央値をカットオフとすることが定義された。しかし、NRG1に関しては治療開始前時点で症例の50%以上が検出下限(62.5 pg/mL)を下回っていたため、検出下限以上の症例を高NRG1群、検出下限未満の症例を低NRG1群とした。
| N | 奏効割合 | 無増悪生存期間 | 全生存期間 | |
|---|---|---|---|---|
| 高NRG1群 | 14 | 92% | 14.5ヶ月 | 未到達 |
| 低NRG1群 | 17 | 43% | 4.2ヶ月 | 13.6ヶ月 |
| p値 | 0.008 | 0.028 | 0.053 |
- 治療開始時点でのHER2中央値は12.5 ng/mLであり、高HER2群/低HER2群の有効性は下記の通り。
| N | 奏効割合 | 無増悪生存期間 | 全生存期間 | |
|---|---|---|---|---|
| 高HER2群 | 15 | 87% | 11.3ヶ月 | 17.9ヶ月 |
| 低HER2群 | 16 | 50% | 5.8ヶ月 | 16.5ヶ月 |
| p値 | 0.025 | 0.36 | 0.58 |
結語
HER2陽性の進行胃癌/食道胃接合部癌に対する、5週サイクルのSP+T-mab併用療法は、良好な抗腫瘍効果と許容可能な毒性であることが示された。血清のNRG1値は治療効果に関連する可能性が示唆された。
執筆:国立がん研究センター東病院 消化管内科 レジデント 中島 裕理 先生
監修:北海道大学病院 消化器内科 助教 結城 敏志 先生
監修:北海道大学病院 消化器内科 助教 結城 敏志 先生