3.1 Bevacizumab
血管内皮細胞増殖因子(VEGF: vascular endothelial growth factor)は多くの癌種で発現していることが知られており、さらにその高発現は腫瘍の浸潤や転移、再発および予後に関連する。Bevacizumabは、VEGFに対するキメラ型ヒト化IgG1モノクローナル抗体であり、腫瘍血管新生を抑制することにより、腫瘍の増殖あるいは転移を抑制することが期待される。 Bevacizumabは米国では2004年2月に進行大腸癌に対する1次治療として承認されている。日本においても2007年4月に「治癒切除不能な進行・再発の結腸・直腸癌」に対する治療薬として承認された。 Bevacizumabを始め血管新生阻害薬に起因する特徴的な有害事象としては、高血圧、蛋白尿、出血、消化管穿孔、瘻孔、血栓塞栓症などが知られている。
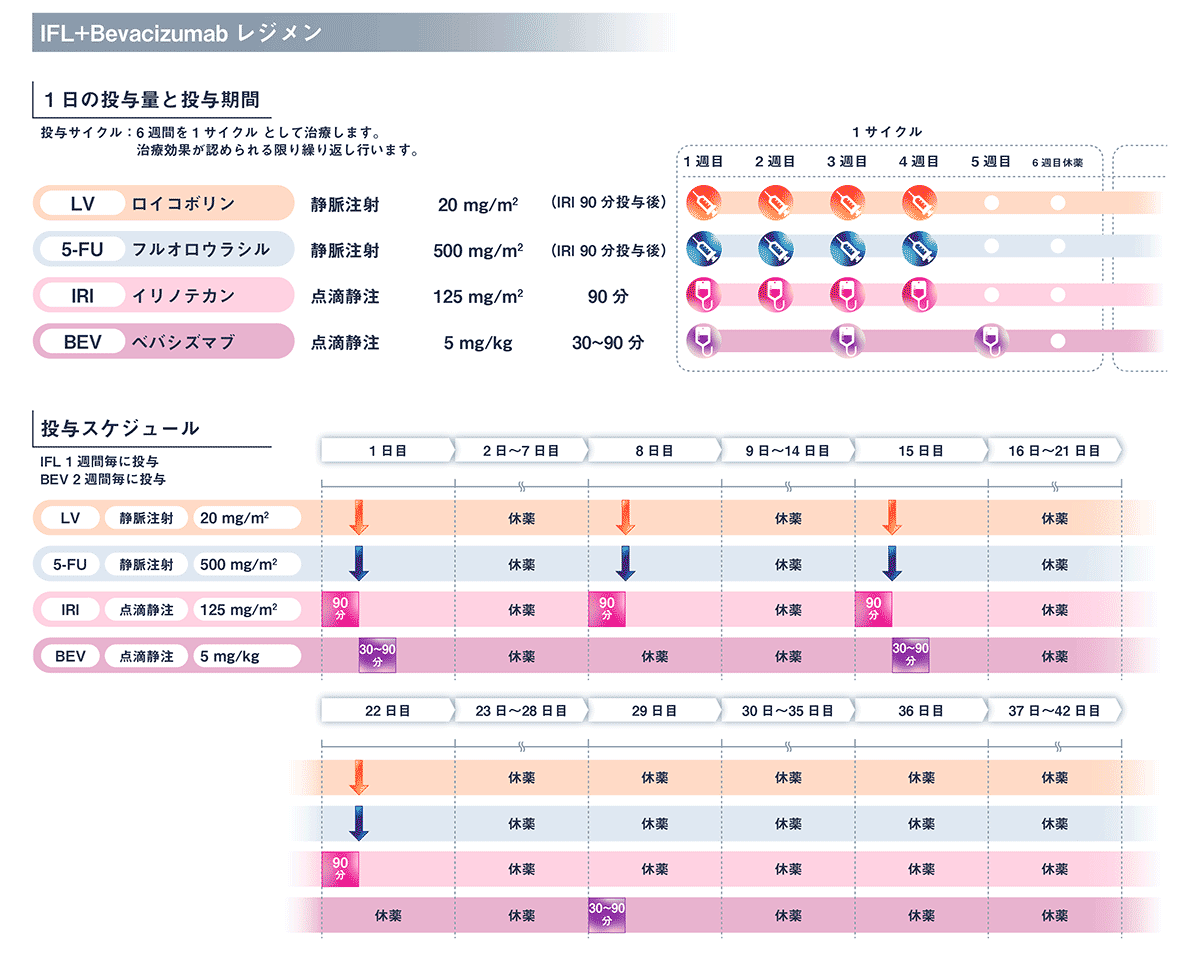
3.1.1 IFL+Bevacizumab
Hurwitzらは初回治療例を対象に、IFLをコントロールアームとして、IFL+Bevacizumabと5-FU/LV+Bevacizumabの無作為化第III相試験を行った(AVF2107g試験)。中間解析において、IFL+Bevacizumabの安全性が認容可能であったことより、本試験はIFLとIFL+Bevacizumabの2群間の比較試験として継続された。その結果、主要評価項目であるOS(IFL+Bevacizumab vs. IFL=20.3か月 vs. 15.6か月, HR=0.66, p<0.001)およびPFS(各々10.6か月 vs. 6.2か月, HR=0.54, p<0.001)、奏効割合(各々45% vs. 35%, p=0.004)のいずれにおいてもBevacizumab併用群が上回った。有害事象は、Bevacizumab併用群で高血圧の頻度が有意に多かったものの、その他については有意な差を認めなかった1)。この結果を受けて2004年2月に米国FDAは、切除不能進行・再発大腸癌に対する1次治療において、5-FUをベースとしたレジメンの併用薬としてBevacizumabを承認した。