| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| HER2陽性 胃癌/食道胃接合部癌 |
一次治療 | 第2相 | 奏効割合 | 日本 | あり |
試験名 :HERBIS-1 試験
レジメン:S-1+シスプラチン+トラスツズマブ
登録期間:2011年7月〜2012年5月
背景
胃癌は世界的に癌による死因の第二位である。進行胃癌に対する世界標準のレジメンは確立していない。西欧諸国ではフッ化ピリミジン製剤(5-FUまたは経口製剤)と白金製剤に、ドセタキセルまたはエピルビシンを含むレジメンが最も広く使用されている。日本と韓国を含む東アジアでは、フッ化ピリミジン製剤と白金製剤の併用が標準的な治療として使用されている。
トラスツズマブ(Tmab)はHER2を標的とするモノクローナル抗体であり、細胞内チロシンキナーゼの活性化を阻害する薬剤である。国際共同第3相試験であるToGA試験によって、HER2陽性胃癌に対しCDDPとフッ化ピリミジン製剤(カペシタビン(Cape)もしくは5-FU)の併用療法にTmabを併用することで全生存期間を延長することが示された。米国食品医薬品局(FDA)と欧州医薬品庁(EMA)ではHER2陽性進行胃癌の治療にTmabを承認しており、Tmab+CDDP+Capeもしくは5-FU併用療法は、西欧諸国ではHER2陽性進行胃癌の標準治療となっている。
S-1は5-FUのプロドラッグであるテガフール、ギメラシルとオテラシルカリウムをモル比1:0.4:1で組み合わせたフッ化ピリミジン製剤である。進行胃癌を対象とした2つの第2相試験では奏効割合が40%を超えることが報告されている。S-1+CDDP併用療法とS-1単剤療法との無作為化比較第3相試験であるSPIRITS試験の結果より、S-1+CDDP併用療法が東アジアにおける進行胃癌の標準的一次化学療法として確立した。しかし、HER2陽性胃癌に対するS-1+CDDP+Tmab併用療法の有効性と安全性は報告されていない。このためS-1+CDDP+Tmab併用療法の有効性と安全性を評価するためにHERBIS-1試験を実施した。
トラスツズマブ(Tmab)はHER2を標的とするモノクローナル抗体であり、細胞内チロシンキナーゼの活性化を阻害する薬剤である。国際共同第3相試験であるToGA試験によって、HER2陽性胃癌に対しCDDPとフッ化ピリミジン製剤(カペシタビン(Cape)もしくは5-FU)の併用療法にTmabを併用することで全生存期間を延長することが示された。米国食品医薬品局(FDA)と欧州医薬品庁(EMA)ではHER2陽性進行胃癌の治療にTmabを承認しており、Tmab+CDDP+Capeもしくは5-FU併用療法は、西欧諸国ではHER2陽性進行胃癌の標準治療となっている。
S-1は5-FUのプロドラッグであるテガフール、ギメラシルとオテラシルカリウムをモル比1:0.4:1で組み合わせたフッ化ピリミジン製剤である。進行胃癌を対象とした2つの第2相試験では奏効割合が40%を超えることが報告されている。S-1+CDDP併用療法とS-1単剤療法との無作為化比較第3相試験であるSPIRITS試験の結果より、S-1+CDDP併用療法が東アジアにおける進行胃癌の標準的一次化学療法として確立した。しかし、HER2陽性胃癌に対するS-1+CDDP+Tmab併用療法の有効性と安全性は報告されていない。このためS-1+CDDP+Tmab併用療法の有効性と安全性を評価するためにHERBIS-1試験を実施した。
シェーマ
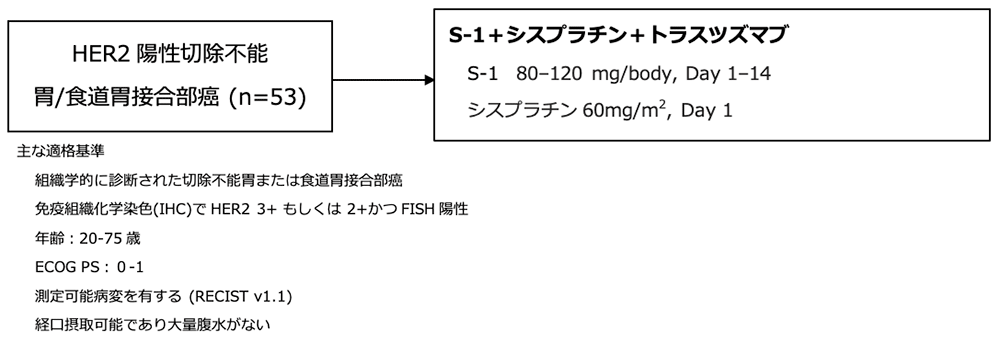
統計学的事項
主要評価項目:奏効割合
必要なサンプルサイズは期待奏効割合50%、閾値奏効割合35%、検出力80%、片側α=0.10の設定に基づいて推定された。不適格例を2%と考慮し、目標症例数は50人と決定した。有効性は、試験治療を少なくとも1回受けたすべての患者で評価された。試験結果:
- 2011年7月から2012年5月の間に日本国内29施設から56例が登録された。腎機能低下や測定可能病変を持たない2例の患者が不適格で、54例が適格と判断された。
患者背景
| N=54 | ||
|---|---|---|
| 年齢(歳) | 中央値 範囲 |
66 34-75 |
| 性別 | 男性 女性 |
42 (78%) 12 (22%) |
| ECOG PS | 0 1 |
42 (78%) 12 (22%) |
| 組織型 | 分化型 未分化型 |
36 (67%) 18 (33%) |
| 胃切除歴 | なし あり |
45 (83%) 9 (17%) |
| 疾患状態 | 切除不能進行例 再発例(術後補助化学療法施行) 再発例(術後補助化学療法未施行) |
51 (94%) 2 (4%) 1 (2%) |
| 転移臓器 | リンパ節 肝 肺 腹膜 骨 その他 |
44 (81%) 32 (59%) 5 (9%) 5 (9%) 2 (4%) 1 (2%) |
| HER2 status | IHC 3+ IHC 2+ かつ FISH陽性 |
45 (83%) 9 (17%) |
2. 治療状況
- 54例の適格例のうち、1例は登録後のヘモグロビン低下のため試験治療を受けなかった。このため有効性と安全性の分析は残りの53例のfull analysis setで実施した。
- 投与サイクル中央値は6(範囲:1-27)で、S-1、CDDP、Tmabの相対用量強度中央値は、それぞれ76%、83%および96%であった。
- 解析時点で51例の患者が治療を中止しており、主な中止理由は病勢進行(31例)、有害事象(16例)であった。4例が腫瘍縮小により手術を受けた。
3. 奏効割合(主要評価項目)
| n=53 | 95%信頼区間 | |
|---|---|---|
| CR PR SD PD |
2 (4%) 34 (64%) 14 (26%) 3 (6%) |
― |
| 奏効割合 | 68% | (54-80%) |
| 病勢制御割合 | 94% | (84-99%) |
- 主要評価項目である奏効割合は68%(95%信頼区間 54-80%、80%信頼区間 58-76%)であり、帰無仮説(奏効割合 35%以下)は棄却された(p<0.001)。
- 分化型症例(n=35)と未分化型症例(n=18)の奏効割合はそれぞれ69%(95%信頼区間 51-83%)、67%(95%信頼区間 41-87%)であった。
- CRまたはPRであった36例において、奏効までの期間中央値は41日(範囲:33-91日)、奏効期間中央値208日(範囲:42-630日)であった。
4. 全生存期間
| N | 中央値 (95%信頼区間) | 1年生存割合 (95%信頼区間) |
|---|---|---|
| 53 | 16.0ヶ月 (13.3-not applicable) | 67.9% (56.5-81.7) |
- 53例の解析時(2013年8月)の観察期間中央値は13.5ヵ月であった。
5. 無増悪生存期間
| N | 中央値 (95%信頼区間) | 1年無増悪生存割合 (95%信頼区間) |
|---|---|---|
| 53 | 7.8ヶ月 (6.0-8.8) | 17.0% (9.4-30.8) |
6. 治療成功期間
| N | 中央値 (95%信頼区間) | 1年治療成功割合 (95%信頼区間) |
|---|---|---|
| 53 | 5.7ヶ月 (4.2-7.1) | 5.1% (1.4-18.6) |
7. 有害事象(CTCAE v4.0, 10%以上の事象を抜粋)
| Grade | ||||||
|---|---|---|---|---|---|---|
| イベント | 1 | 2 | 3 | 4 | 全Grade (%) | Grade 3-4 (%) |
| 白血球減少 | 17 | 18 | 3 | 1 | 74 | 8 |
| 好中球数減少 | 8 | 5 | 14 | 5 | 60 | 36 |
| 発熱性好中球減少症 | 0 | 0 | 1 | 1 | 4 | 4 |
| 貧血 | 5 | 22 | 6 | 2 | 66 | 15 |
| 血小板数減少 | 20 | 6 | 0 | 0 | 49 | 0 |
| 食欲不振 | 15 | 15 | 12 | 0 | 79 | 23 |
| 疲労 | 18 | 14 | 2 | 0 | 64 | 4 |
| 悪心 | 20 | 12 | 1 | 0 | 62 | 2 |
| 低アルブミン血症 | 14 | 6 | 5 | 0 | 47 | 9 |
| 高血圧 | 9 | 12 | 1 | 0 | 42 | 2 |
| クレアチニン増加 | 21 | 0 | 3 | 0 | 45 | 6 |
| 下痢 | 10 | 7 | 4 | 0 | 40 | 8 |
| 口腔粘膜炎 | 10 | 6 | 1 | 0 | 32 | 2 |
| 皮疹 | 12 | 1 | 0 | 0 | 25 | 0 |
| 嘔吐 | 7 | 3 | 3 | 0 | 25 | 6 |
| ALT増加 | 11 | 2 | 0 | 0 | 25 | 0 |
| 便秘 | 7 | 4 | 0 | 0 | 21 | 0 |
| 味覚異常 | 7 | 3 | 0 | 0 | 19 | 0 |
| AST増加 | 9 | 0 | 0 | 0 | 17 | 0 |
| 血中ビリルビン増加 | 6 | 2 | 0 | 0 | 15 | 0 |
| 浮腫 | 6 | 2 | 0 | 0 | 15 | 0 |
| 末梢性感覚ニューロパチー | 1 | 5 | 0 | 0 | 11 | 0 |
- 食欲不振を除いて、患者の10%以上で発生したGrade 3-4の非血液学的有害事象は認めなかった。
- Grade 2の注入に伴う反応(Infusion related reaction)は3例(6%)に発症した。
- 心不全を発症した症例は認めなかった。
- 骨髄抑制に起因する治療関連死亡を1件認めた。この患者は登録前のクレアチニンクリアランスが47.4 mL/minであったため、後に不適格と判断された。さらに7日目の血清クレアチニンが2.31 mg/dLであったにもかかわらずS-1投与が継続された。腎機能障害により骨髄抑制が起こり、死亡に至った。患者記録を検討した結果、効果安全性評価委員会は、適格基準及び治療プロトコールからの重大な逸脱により患者が死亡したと判断した。
結語
本研究は無作為化比較試験ではないが、S-1+CDDP+Tmab併用療法は良好な毒性プロファイルと高い有効性を示した。
執筆:神奈川県立がんセンター 消化器内科 医長 古田 光寛 先生
監修:岐阜大学医学部附属病院 がんセンター 副センター長/准教授 牧山 明資 先生
監修:岐阜大学医学部附属病院 がんセンター 副センター長/准教授 牧山 明資 先生