| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 胃癌 | 二次治療 | 第2相 | 奏効割合 | 国内 | あり |
試験名 :なし
レジメン:ナブパクリタキセル+ラムシルマブ
登録期間:2016年1月〜2016年5月
背景
パクリタキセル+ラムシルマブ併用療法はRAINBOW試験において一次治療後の進行胃癌症例を対象に、パクリタキセル+プラセボと比較して有意な生存延長を示したことから標準的二次化学療法として位置づけられた。
一方、アルブミン懸濁型パクリタキセル(ナブパクリタキセル)は既存のパクリタキセル製剤で必要とされたポリオキシエチレンヒマシ油(クレモホールEL®)や無水エタノールの溶媒を必要としないため、溶媒に起因した過敏症の発現リスクがなく、アルコール不耐症例への投与も可能になるなど、利便性が向上した薬剤である。ナブパクリタキセルの毎週投与法は、胃癌二次化学療法を対象としたABSOLUTE試験において、パクリタキセルの毎週投与法と非劣勢が示されており、本試験においてナブパクリタキセル+ラムシルマブ併用療法の安全性と有効性を評価するに至った。
一方、アルブミン懸濁型パクリタキセル(ナブパクリタキセル)は既存のパクリタキセル製剤で必要とされたポリオキシエチレンヒマシ油(クレモホールEL®)や無水エタノールの溶媒を必要としないため、溶媒に起因した過敏症の発現リスクがなく、アルコール不耐症例への投与も可能になるなど、利便性が向上した薬剤である。ナブパクリタキセルの毎週投与法は、胃癌二次化学療法を対象としたABSOLUTE試験において、パクリタキセルの毎週投与法と非劣勢が示されており、本試験においてナブパクリタキセル+ラムシルマブ併用療法の安全性と有効性を評価するに至った。
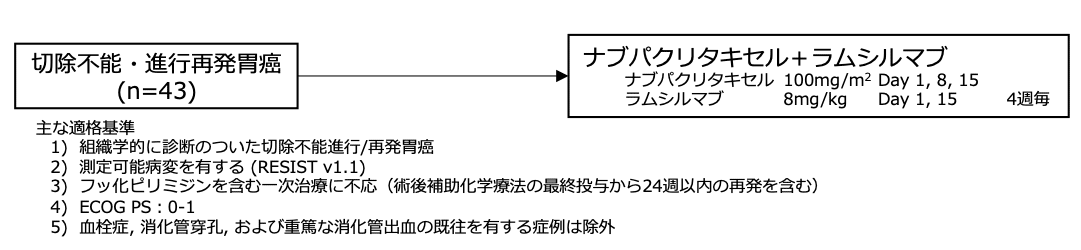
シェーマ
統計学的事項
主要評価項目:全奏効割合 (独立評価委員会による評価)
RAINBOW試験、およびナブパクリタキセルの有効性と安全性を評価した国内第2相試験(J-0200試験)の結果から、本試験では閾値奏効割合を20%、期待奏効割合を40%とした。片側有意水準 5%, 検出力 80%とし、目標症例数は40例と算出された。試験結果:
- 2016年1月から2016年5月の間に、日本国内12施設から45例が登録され、43例が試験治療を受けた。
- 測定可能病変を有さなかった1例を除外した42例をfull analysis set(FAS)として有効性の解析が行われ、安全性の解析は試験治療を受けた43例を対象とした。
- 観察期間中央値は8.6ヶ月(範囲:4.3-11.3)であった。
1. 投与状況
- データカットオフの時点で7例が治療継続中であり、治療中止となった35例の治療中止理由は34例が病勢進行、1例が有害事象であった。
- 投与サイクル数中央値:6サイクル(範囲:1-11)、投与期間中央値:5.6ヶ月(範囲:0.5-10.2)。
- 総投与量中央値:ナブパクリタキセル 2013mg(範囲:163-4878)、ラムシルマブ 5148mg(範囲 754-11991)。
- 相対用量強度中央値:ナブパクリタキセル 61.8%(範囲:28.5-99.8)、ラムシルマブ 87.6%(範囲:33.2-100.0)。
- 26例が三次治療を受け、その内23例がイリノテカンベースの治療を受けた。
2. 全奏効割合 (主要評価項目)
| 症例数 | CR | PR | SD | PD | NE | 全奏効割合 | 90%信頼区間 |
|---|---|---|---|---|---|---|---|
| 42 | 2 | 21 | 16 | 3 | 0 | 54.8% | 41.0-68.0 |
- 42例中、40例で腫瘍縮小を認め、奏効までの期間中央値は36日(範囲:29-155)であった。
3. 病勢制御割合
| 症例数 | 病勢制御割合 | 95%信頼区間 |
|---|---|---|
| 42 | 92.9% | 80.5-98.5 |
4. 無増悪生存期間 (独立評価委員会による評価)
| 症例数 | イベント数 | 中央値 | 95%信頼区間 |
|---|---|---|---|
| 42 | 27 | 7.6ヶ月 | 5.4-8.1 |
- 8例は主治医評価では増悪と判断されたが、独立評価委員会では増悪と判断されず、打ち切りとされた。
- データカットオフ時点で生存期間中央値は未到達であった。
5. 治療関連有害事象 (CTCAE ver.4.03)
| N (%) | N=43 | |
|---|---|---|
| 全Grade | Grade 3以上 | |
| 全事象 | 43 (100.0) | 38 (88.4) |
| 血液学的有害事象 | ||
| 好中球数減少 | 39 (90.7) | 33 (76.7) |
| 白血球減少 | 16 (37.2) | 12 (27.9) |
| 貧血 | 7 (16.3) | 5 (11.6) |
| 発熱性好中球数減少 | 2 (4.7) | 2 (4.7) |
| 非血液学的有害事象 | ||
| 脱毛症 | 40 (93.0) | 0 (0.0) |
| 末梢性感覚ニューロパチー | 25 (58.1) | 0 (0.0) |
| 鼻出血 | 20 (46.5) | 0 (0.0) |
| 高血圧 | 18 (41.9) | 2 (4.7) |
| 口腔粘膜炎 | 11 (25.6) | 0 (0.0) |
| 下痢 | 10 (23.3) | 0 (0.0) |
| 発疹 | 10 (23.3) | 0 (0.0) |
| 食欲不振 | 8 (18.6) | 3 (7.0) |
| 浮腫 | 8 (18.6) | 0 (0.0) |
| 疲労 | 7 (16.3) | 0 (0.0) |
- 過敏反応と輸注反応(インフュージョンリアクション)は認めなかった。
- ラムシルマブに特徴的なGrade 3-4の治療関連有害事象として、蛋白尿(2例/4.7%)、深部静脈血栓症(1例/2.3%)、肺血栓症(1例/2.3%)、胃出血(1例/2.3%)、上部消化管出血(1例/2.3%)が報告された。
- 消化管穿孔が1例(2.3%)報告されたが、原疾患の増悪に起因するものと考えられた。
- 治療関連死亡は認めなかった。
- ナブパクリタキセルの減量/休薬に至った有害事象はそれぞれ29例(67.4%)/36例(83.7%)に認められ、その内、好中球数減少による減量/休薬は25例(58.1%)/30例(69.8%)であった。
- ラムシルマブの減量/休薬に至った有害事象はそれぞれ4例(9.3%)/18例(41.9%)に認められ、その内、好中球数減少による休薬が5例(11.6%)と最多だった。
- ラムシルマブの投与中止に至った有害事象は、胃出血、上部消化管出血、消化管穿孔が各1例、蛋白尿が2例であった。一方、ナブパクリタキセルの投与中止に至った有害事象はなかった。
6. QOL
| EQ-5D* index scoreの平均値 | |
|---|---|
| ベースライン | 0.8592 [± 標準偏差 0.1270] |
| 8週 | 0.8494 [± 標準偏差 0.1395] |
| 16週 | 0.8263 [± 標準偏差 0.2442] |
| 24週 | 0.8221 [± 標準偏差 0.2364] |
| 48週 | 0.6554 [± 標準偏差 0.3675] |
*the EuroQol 5 Dimension questionnaire
- 試験期間中にQOLの悪化は観察されなかった。
結語
ナブパクリタキセル+ラムシルマブ併用療法は有望な有効性と認容可能な安全性を示し、進行胃癌患者に対する有用な二次治療の選択肢となり得る。
執筆:釧路ろうさい病院 腫瘍内科 部長 原田 一顕 先生
監修:北海道大学病院 消化器内科 助教 結城 敏志 先生
監修:北海道大学病院 消化器内科 助教 結城 敏志 先生