| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 胃癌/食道胃接合部癌 | 一次治療 | 第3相 | 全生存期間 | 日本・韓国 | あり |
試験名 :SOLAR
レジメン:TAS-118+オキサリプラチン vs S-1+シスプラチン
登録期間:2015年1月〜2016年12月
背景
切除不能胃/食道胃接合部癌に対する一次治療として、各種ガイドラインにおいてフッ化ピリミジン系薬剤と白金製剤の併用化学療法が推奨されている(HER2陽性症例に対するトラスツズマブ併用を含め)。現在、フッ化ピリミジン系薬剤としては5-FU、S-1、カペシタビン(Cape)、白金製剤としてはシスプラチン(CDDP)、オキサリプラチン(OX)があり、多種の併用化学療法が存在するが、その有効性は同程度であり、東アジアにおいてはJCOG9912試験、SPIRITS試験の結果よりS-1+シスプラチン療法が進行胃癌に対する一次化学療法として広く使用されている。
5-FUにロイコボリン(LV)を併用することは結腸癌では一般的に行われている。3000人以上の患者を対象としたメタ解析において、5-FU+LV療法は5-FU単独療法と比較して、奏効割合や全生存期間を改善させることが報告されている。同様に、S-1(1週内服1週休薬:2週毎)にLVを併用することで、S-1の抗腫瘍活性を増加させることが報告されている。
進行胃癌を対象とした、S-1+LV+OXとS-1+CDDPの無作為化比較第2相試験では、奏効割合(各々 66% vs 46%)、無増悪生存期間(HR 0.60, 95%信頼区間 0.35-1.02)、全生存期間(HR 0.59, 95%信頼区間 0.37-0.93)のいずれもS-1+LV+OX群で良好な成績を示した1)。TAS-118はS-1とLVを含有する新規経口薬であり、進行胃癌を対象としてTAS-118+OXとS-1+CDDPの有効性と安全性を比較する第3相試験を行った。
5-FUにロイコボリン(LV)を併用することは結腸癌では一般的に行われている。3000人以上の患者を対象としたメタ解析において、5-FU+LV療法は5-FU単独療法と比較して、奏効割合や全生存期間を改善させることが報告されている。同様に、S-1(1週内服1週休薬:2週毎)にLVを併用することで、S-1の抗腫瘍活性を増加させることが報告されている。
進行胃癌を対象とした、S-1+LV+OXとS-1+CDDPの無作為化比較第2相試験では、奏効割合(各々 66% vs 46%)、無増悪生存期間(HR 0.60, 95%信頼区間 0.35-1.02)、全生存期間(HR 0.59, 95%信頼区間 0.37-0.93)のいずれもS-1+LV+OX群で良好な成績を示した1)。TAS-118はS-1とLVを含有する新規経口薬であり、進行胃癌を対象としてTAS-118+OXとS-1+CDDPの有効性と安全性を比較する第3相試験を行った。
シェーマ
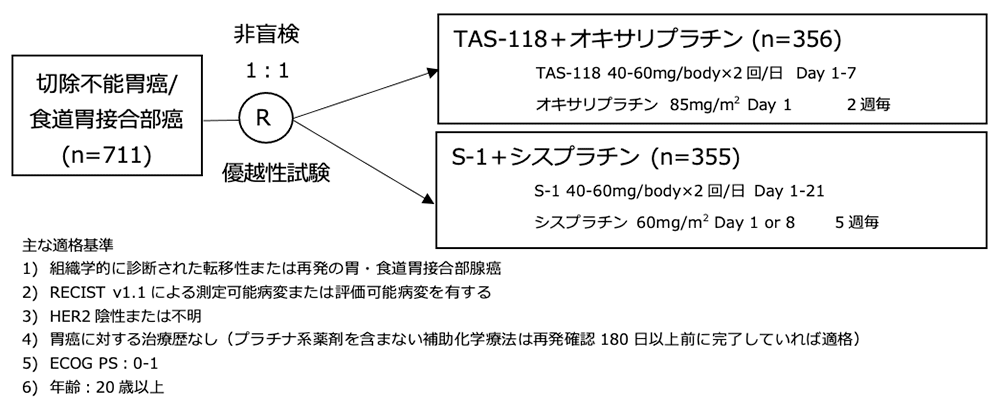
統計学的事項
主要評価項目:全生存期間
少なくとも1回薬剤投与を受けた集団をFull Analysis Set(FAS)と定義し、安全性・奏効割合を除く全ての評価項目の解析対象とした。2018年3月に効果安全性評価委員会よりランダム化の際に測定可能または評価可能な転移性病変を持たないことが判明した不適格症例をFASから除外することが勧告されたため、主解析は不適格症例を除外したFASで実施された。S-1+シスプラチン群の全生存期間中央値を14.5ヶ月、TAS-118+OX群の中央値を19.3ヶ月と推定した場合のハザード比は0.75であり、両側α=0.05、検出力85%で必要症例数を設定したところ、437イベント、686例の登録が必要とされた。その後、日本と韓国で承認されたRamやNivoを使用した後治療の生存への影響を考慮して、効果安全性評価委員会の勧告に基づき、2回目の中間解析前の2017年4月12日にプロトコール改訂を行った。予定登録数は変更せずに、全生存期間中央値をそれぞれS-1+CDDP群 15.5ヶ月、TAS-118+OX群 19.3ヶ月と再設定し、491の死亡イベントが発生した時点で主解析を行うこととした。
割付調整因子にはECOG PS(0 vs 1)、測定可能病変(あり vs なし)、国(日本 vs 韓国)が用いられた。
試験結果:
- 2015年1月28日から2016年12月5日の間に、日本 52施設、韓国 10施設より794例がスクリーニングされ、そのうち711例が登録され、356例がTAS-118+OX群に、355例がS-1+CDDP群に割り付けられた。
- TAS-118+OX群の4例、S-1+CDDP群の7例は試験治療が行われなかった。
- 2018年3月に独立効果安全性評価委員会でベースラインの画像評価を行い、測定可能または評価可能病変の有無を確認したところ、19例(TAS-118+OX群 5例、S-1+CDDP群 14例)が不適格と判定され、この19例は主解析へ含めないことを勧告された。上記より主解析の対象症例数は、681例(TAS-118+OX群 347例、S-1+CDDP群 334例)となった。
1. 全生存期間(主要評価項目)
| N | イベント | 中央値 | 95%信頼区間 | |
|---|---|---|---|---|
| TAS-118+OX | 347 | 233(67%) | 16.0ヶ月 | 13.8-18.3 |
| S-1+CDDP | 334 | 258(77%) | 15.1ヶ月 | 13.6-16.4 |
HR 0.83 (95%信頼区間 0.69-0.99), p=0.039
- 主要解析のデータカットオフ日は2018年8月29日で、追跡期間中央値は、全体で26.0ヶ月(四分位範囲:22.0–32.8)、TAS-118+OX群で25.9ヶ月(四分位範囲:21.6–31.9)、S-1+CDDP群で27.1ヶ月(四分位範囲:22.3–33.2)であった。
2. 全生存期間に関するサブグループ解析
| TAS-118+OX (イベント/N) |
S-1+CDDP (イベント/N) |
HR (95%信頼区間) | P値(交互作用) | |
|---|---|---|---|---|
| 性別 男性 女性 |
168/251 65/96 |
165/218 93/116 |
0.87 (0.70-1.08) 0.70 (0.51-0.97) |
0.40 |
| 年齢 65歳未満 65歳以上 |
144/201 89/146 |
155/194 103/140 |
0.85 (0.68-1.07) 0.78 (0.58-1.03) |
0.58 |
| 国 日本 韓国 |
138/221 95/126 |
149/212 109/122 |
0.86 (0.69-1.09) 0.76 (0.58-1.00) |
0.46 |
| 体表面積(m2) 1.25未満 1.25以上1.50未満 1.50以上 |
0/2 49/69 184/276 |
5/5 54/72 199/257 |
― 0.82 (0.56-1.21) 0.83 (0.68-1.02) |
1.00 |
| ECOG PS 0 1 |
114/192 119/155 |
130/180 128/154 |
0.71 (0.56-0.92) 1.00 (0.78-1.28) |
0.071 |
| 原発巣 なし あり |
32/60 201/287 |
33/57 225/277 |
0.84 (0.52-1.37) 0.82 (0.68-0.99) |
0.86 |
| 原発部位 胃 胃食道接合部 |
224/331 9/16 |
248/319 10/15 |
0.82 (0.69-0.98) 0.75 (0.31-1.86) |
0.97 |
| 組織型 びまん型(未分化型) 腸型(分化型) |
171/241 62/105 |
186/233 71/100 |
0.82 (0.66-1.01) 0.82 (0.59-1.16) |
0.94 |
| 疾患状態 Stage IV 再発 |
203/294 30/53 |
235/295 23/39 |
0.81 (0.67-0.98) 0.93 (0.54-1.61) |
0.53 |
| 測定可能病変 なし あり |
81/127 152/220 |
92/120 166/214 |
0.74 (0.55-1.00) 0.87 (0.70-1.99) |
0.45 |
| 転移臓器個数 1 2 3以上 |
77/127 102/146 54/74 |
78/115 114/143 66/76 |
0.88 (0.64-1.20) 0.89 (0.68-1.16) 0.67 (0.46-0.96) |
0.29 |
| 肝転移 なし あり |
164/251 69/96 |
186/239 72/95 |
0.75 (0.61-0.93) 1.01 (0.73-1.41) |
0.13 |
| 腹膜播種 なし あり |
146/212 87/135 |
150/200 108/134 |
0.94 (0.75-1.18) 0.66 (0.50-0.87) |
0.066 |
| 腹水 なし あり |
162/245 71/102 |
173/232 85/102 |
0.85 (0.69-1.06) 0.77 (0.56-1.06) |
0.51 |
| リンパ節転移 なし あり |
60/106 173/241 |
63/92 195/242 |
0.80 (0.56-1.14) 0.85 (0.69-1.04) |
0.80 |
- ほとんどのサブグループは、全対象と一致する結果を示した。
3. 無増悪生存期間
| N | イベント | 中央値 | 95%信頼区間 | |
|---|---|---|---|---|
| TAS-118+OX | 347 | 268(77%) | 7.1ヶ月 | 6.8-8.3 |
| S-1+CDDP | 334 | 278(83%) | 6.4ヶ月 | 5.6-6.9 |
HR 0.79 (95%信頼区間 0.66-0.93), p=0.0045
- ほとんどのサブグループは、全対象と一致する結果を示した。
4. 奏効割合/腫瘍縮小率 (測定可能病変を有する423例が対象)
| TAS-118+OX (n=211) | S-1+CDDP (n=212) | p値 | |
|---|---|---|---|
| CR PR SD PD NE |
6 (3%) 149 (71%) 42 (20%) 13 (6%) 1 (<1%) |
7 (3%) 99 (47%) 81 (38%) 24 (11%) 1 (<1%) |
― |
| 奏効割合 (95%信頼区間) |
155 (73%) (67.0-79.3) |
106 (50%) (43.1-56.9) |
<0.0001 |
| 病勢制御割合 (95%信頼区間) |
197 (93%) (89.1-96.3) |
187 (88%) (83.1-92.2) |
― |
| 最大腫瘍縮小率 (範囲) |
-52.94% (-100.0-74.6) |
-33.85% (-100.0-126.8) |
<0.001 |
| 6週時点の腫瘍縮小率 (範囲) |
-34.57% (-79.0-74.6) |
-18.93% (-100.0-126.8) |
<0.001 |
| 12週時点の腫瘍縮小率 (範囲) |
-45.02% (-100.0-173.4) |
-33.60% (-100.0-85.7) |
0.002 |
5. 治療成功期間
| N | イベント | 中央値 | 95%信頼区間 | |
|---|---|---|---|---|
| TAS-118+OX | 347 | 330(95%) | 6.1ヶ月 | 5.6-6.7 |
| S-1+CDDP | 334 | 325(97%) | 5.3ヶ月 | 4.7-6.2 |
HR 0.82 (95%信頼区間 0.70-0.96), p=0.011
6. 投与状況/後治療
| N (%) | TAS-118+OX (n=347) | S-1+CDDP (n=334) |
|---|---|---|
| データカットオフ時点での治療中止例 | 330 (95) | 325 (97) |
| 治療中止理由 病勢進行 28日を越える有害事象のため次サイクル開始遅延 患者希望または医師判断 腫瘍縮小による手術移行 その他 |
253 (77) 24 (7) 35 (11) 16 (5) 2 (1) |
258 (79) 33 (10) 25 (8) 9 (3) 0 (0) |
| 後治療移行 | 269 (82) | 280 (86) |
- 中止につながる最も頻度の高い有害事象は食欲不振であった(TAS-118+OX群3例[1%] vs S-1+CDDP群 3例[1%])。
- 減量:TAS-118+OX群では、173例(50%)でTAS-118の減量を要し、167例(48%)でOXの減量を要した。S-1+CDDP群では、113例(34%)でS-1の減量を要し、94例(28%)でCDDPの減量を要した。
- 投与延期:TAS-118+OX群の307例(88%)、およびS-1+CDDP群の230例(69%)で1回以上の投与延期を要した。
7. 相対用量強度
| N (%) | TAS-118+OX | S-1+CDDP |
|---|---|---|
| TAS-118 (四分位範囲) |
79.6% (67.5-91.7) |
― |
| S-1 (四分位範囲) |
― | 86.7% (74.5-95.5) |
| OX (四分位範囲) |
68.3% (46.3-87.5) |
― |
| CDDP (四分位範囲) |
― | 91.6% (67.0-100.0) |
8. 有害事象 (CTCAE v4.03)
| N (%) | TAS-118+OX (n=352) | S-1+CDDP (n=348) | ||||
|---|---|---|---|---|---|---|
| Grade 1-2 | Grade 3 | Grade 4 | Grade 1-2 | Grade 3 | Grade 4 | |
| 好中球数減少 | 86 (24) | 47 (13) | 7 (2) | 80 (23) | 68 (20) | 20 (6) |
| 貧血 | 75 (21) | 56 (16) | 0 (0) | 74 (21) | 63 (18) | 1 (<1) |
| 血小板数減少 | 105 (30) | 3 (1) | 4 (1) | 66 (19) | 13 (4) | 7 (2) |
| 白血球減少 | 52 (15) | 6 (2) | 1 (<1) | 62 (18) | 30 (9) | 5 (1) |
| 末梢性感覚ニューロパチー | 212 (60) | 30 (9) | 0 (0) | 57 (16) | 1 (<1) | 0 (0) |
| 悪心 | 200 (57) | 14 (4) | 0 (0) | 188 (54) | 11 (3) | 0 (0) |
| 食欲不振 | 196 (56) | 53 (15) | 0 (0) | 191 (55) | 46 (13) | 0 (0) |
| 下痢 | 174 (49) | 33 (9) | 0 (0) | 134 (39) | 15 (4) | 0 (0) |
| 口腔粘膜炎 | 140 (40) | 13 (4) | 0 (0) | 83 (24) | 5 (1) | 0 (0) |
| 便秘 | 128 (36) | 4 (1) | 0 (0) | 145 (42) | 0 (0) | 0 (0) |
| 嘔吐 | 120 (34) | 6 (2) | 0 (0) | 91 (26) | 6 (2) | 0 (0) |
| 疲労 | 113 (32) | 10 (3) | 0 (0) | 102 (29) | 9 (3) | 0 (0) |
| 味覚異常 | 111 (32) | 1 (<1) | 0 (0) | 82 (24) | 0 (0) | 0 (0) |
| 腹痛 | 88 (25) | 10 (3) | 0 (0) | 77 (22) | 6 (2) | 0 (0) |
| 発熱 | 83 (24) | 2 (1) | 0 (0) | 79 (23) | 0 (0) | 0 (0) |
| 体重減少 | 83 (24) | 19 (5) | 0 (0) | 53 (15) | 10 (3) | 0 (0) |
| 倦怠感 | 81 (23) | 2 (1) | 0 (0) | 76 (22) | 3 (1) | 0 (0) |
| 皮膚色素過剰 | 64 (18) | 0 (0) | 0 (0) | 50 (14) | 0 (0) | 0 (0) |
| 手掌・測定発赤知覚不全症候群 | 58 (16) | 3 (1) | 0 (0) | 27 (8) | 1 (<1) | 0 (0) |
| AST増加 | 54 (15) | 8 (2) | 0 (0) | 21 (6) | 5 (1) | 0 (0) |
| 低アルブミン血症 | 48 (14) | 13 (4) | 0 (0) | 34 (10) | 12 (3) | 0 (0) |
| 消化不良 | 48 (14) | 0 (0) | 0 (0) | 24 (7) | 0 (0) | 0 (0) |
| ALT増加 | 48 (14) | 6 (2) | 1 (<1) | 19 (5) | 6 (2) | 0 (0) |
| 不眠症 | 46 (13) | 0 (0) | 0 (0) | 27 (8) | 1 (<1) | 0 (0) |
| 流涙 | 41 (12) | 1 (<1) | 0 (0) | 36 (10) | 2 (1) | 0 (0) |
| 鼻咽頭炎 | 38 (11) | 0 (0) | 0 (0) | 22 (6) | 0 (0) | 0 (0) |
| 上気道感染症 | 34 (10) | 0 (0) | 0 (0) | 36 (10) | 0 (0) | 0 (0) |
| しゃっくり | 33 (9) | 0 (0) | 0 (0) | 76 (22) | 2 (1) | 0 (0) |
| 浮動性めまい | 31 (9) | 4 (1) | 0 (0) | 49 (14) | 1 (<1) | 0 (0) |
| 浮腫 | 63 (18) | 0 (0) | 0 (0) | 81 (23) | 1 (<1) | 0 (0) |
| クレアチニン増加 | 10 (3) | 0 (0) | 0 (0) | 36 (10) | 7 (2) | 1 (<1) |
| 発熱性好中球減少症 | 0 (0) | 5 (1) | 1 (<1) | 0 (0) | 7 (2) | 0 (0) |
- TAS-118+OX群で2例(肺結核と単純ヘルペスウイルス性肺炎)の治療関連死亡を認めた。
- 重篤な有害事象は、TAS-118+OX群 352例中155例(44%)、S-1+CDDP群 348例中159例(46%)で観察され、薬物関連の重篤な有害事象はTAS-118+OX群 90例(26%)、S-1+CDDP群 70例(20%)で観察された。両群で最も頻度が高い薬物関連の重篤な有害事象は食欲不振であり、TAS-118+OX群 34例(10%)、S-1+CDDP群 23例(7%)で報告された。
- 事後分析では、TAS-118+OX群またはS-1+CDDP群のいずれにおいても、ECOG PS 0および1の患者間でGrade 3以上の有害事象の発生割合に実質的な差は観察されなかった。
結語
TAS-118+OX併用療法はS-1+CDDP併用療法と比較して切除不能胃癌の全生存期間、無増悪生存期間、奏効割合を改善させた。また、ほとんどの症例で毒性マネジメントも良好であった。TAS-118+CDDP併用療法はアジア人における切除不能胃癌の一次化学療法の選択肢の一つとなり得る。
関連論文
1) Hironaka S, Sugimoto N, Yamaguchi K, et al. S-1 plus leucovorin versus S-1 plus leucovorin and oxaliplatin versus S-1 plus cisplatin in patients with advanced gastric cancer: a randomised, multicentre, open-label, phase 2 trial. The Lancet Oncology 2016;17:99-108.
執筆:静岡県立静岡がんセンター 消化器内科 副医長 白数 洋充 先生
監修:岐阜大学医学部付属病院 がんセンター 副センター長/准教授 牧山 明資 先生
監修:岐阜大学医学部付属病院 がんセンター 副センター長/准教授 牧山 明資 先生