| 対象疾患 | 治療ライン | 研究の相 | 評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| HER2陽性 胃/食道胃接合部癌 |
二次治療 | 第2相 | 無増悪生存期間 | 日本 | あり |
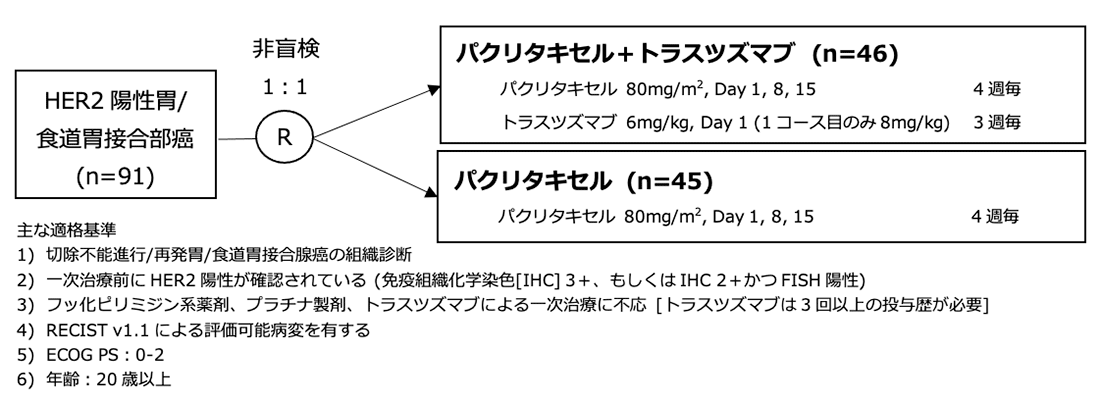
試験名 :WJOG7112G(T-ACT)
レジメン:パクリタキセル+トラスツズマブ vs パクリタキセル単剤療法
登録期間:2012年12月〜2016年10月
背景
HER2は胃/食道胃接合部癌症例の10-20%に過剰発現、または増幅を認める。ToGA試験において、HER2陽性の切除不能・進行再発胃癌に対する一次治療としてフッ化ピリミジン系薬剤(5-FU or カペシタビン(Cape)+シスプラチン(CDDP)+トラスツズマブ(Tmab)併用療法の有効性が示され、同対象に対する標準的一次化学療法と位置づけられた。HER2陽性の切除不能・進行再発胃癌に対する二次治療としてはタキサン系薬剤、イリノテカン(IRI)、あるいはパクリタキセル(PTX)+ラムシルマブ(RAM)が標準治療とされている。
HER2陽性乳癌においては、GBG 26/BIG 03-05試験1)においてTmab既治療例に対するTmab継続投与の意義について検証されており、Cape単剤療法と比較し、Cape+Tmab継続投与において無増悪生存期間(8.2ヶ月 vs 5.6ヶ月, HR 0.69 [95%信頼区間 0.48-0.97], p=0.0338)と奏効割合(48.1% vs 27.0%, オッズ比 2.50, p=0.0115)の有意な改善を示した。
以上の結果に基づいて、一次治療でTmabに不応となったHER2陽性胃/食道胃接合部癌を対象とし、PTXの併用において、Tmab継続投与の意義を評価する多施設共同無作為化比較第2相試験を実施した。
HER2陽性乳癌においては、GBG 26/BIG 03-05試験1)においてTmab既治療例に対するTmab継続投与の意義について検証されており、Cape単剤療法と比較し、Cape+Tmab継続投与において無増悪生存期間(8.2ヶ月 vs 5.6ヶ月, HR 0.69 [95%信頼区間 0.48-0.97], p=0.0338)と奏効割合(48.1% vs 27.0%, オッズ比 2.50, p=0.0115)の有意な改善を示した。
以上の結果に基づいて、一次治療でTmabに不応となったHER2陽性胃/食道胃接合部癌を対象とし、PTXの併用において、Tmab継続投与の意義を評価する多施設共同無作為化比較第2相試験を実施した。
シェーマ
統計学的事項
主要評価項目:無増悪生存期間
先行研究(WJOG 4007試験)の結果に基づいて、PTX単剤群とPTX+Tmab群の無増悪生存期間中央値をそれぞれ3ヶ月、5ヶ月と推定した。検出力80%, 片側α=0.1として必要サンプルサイズは90例であった。無増悪生存期間を除く全ての解析での有意水準は、多重性を調整せず、両側α=0.05に設定された。試験結果:
- 2012年12月から2016年10月の間に日本国内の37施設から91例が無作為割り付けされた(PTX群 n=46、PTX+Tmab群 n=45)。重複癌による不適格が明らかとなった両群各1例を除いた89例をFull analysis set (FAS)、急速な病勢進行でプロトコール治療が行われなかったPTX群の1例を除いた88例をSafety analysis set (SAS)とした。
- 2017年10月3日のデータカットオフ時点で観察期間中央値は両群ともに10ヶ月であった(PTX群 95%信頼区間 7.6-13.0、PTX+Tmab群 8.1-13.0)。
1. 患者背景
| N (%) | PTX群 (N=45) | PTX+Tmab群 (N=44) | |
|---|---|---|---|
| 年齢 (歳) | 中央値 (範囲) | 67 (33-81) | 65 (50-89) |
| 性別 | 男性 女性 |
39 (86.7) 6 (13.3) |
32 (72.7) 12 (27.3) |
| ECOG PS | 0 1 2 |
29 (64.4) 14 (31.1) 2 (4.4) |
24 (54.5) 18 (40.9) 2 (4.5) |
| 原発部位 | 胃 食道胃接合部 |
38 (84.4) 7 (15.6) |
40 (90.9) 4 (9.1) |
| 組織型 | 腸型 (Intestinal) びまん型 (Diffuse) 分類不能 |
25 (55.6) 19 (42.2) 1 (0.2) |
29 (65.9) 15 (34.1) 0 (0) |
| HER2 status | IHC 3+ IHC 2+, FISH陽性 |
34 (75.6) 11 (24.4) |
33 (75.0) 11 (25.0) |
| 胃切除歴 | あり なし |
8 (17.8) 37 (82.2) |
10 (22.7) 34 (77.3) |
| 測定可能病変 | あり なし |
38 (84.4) 7 (15.6) |
39 (88.6) 5 (11.4) |
| 転移臓器 | 肝 腹膜 肺 リンパ節 |
25 (55.6) 16 (35.6) 3 (6.7) 20 (44.4) |
25 (56.8) 18 (40.9) 11 (25.0) 24 (54.5) |
| 転移臓器個数 | 1臓器 2臓器以上 |
26 (57.8) 19 (42.2) |
19 (43.2) 25 (56.8) |
| 一次治療における増悪までの期間 | 6ヶ月未満 6ヶ月以上 |
15 (33.3) 30 (66.7) |
16 (36.4) 28 (63.6) |
| 一次治療の奏効 | CR+PR | 23 (51.1) | 28 (63.6) |
| 一次治療のTmab投与回数 | 中央値 (範囲) | 9 (3-30) | 8 (3-32) |
| Tmab最終投与から無作為化までの期間 | 30日以上 30日未満 |
15 (33.3) 20 (66.7) |
16 (36.4) 28 (63.6) |
- FASにおける患者背景は両群でバランスがとれていた。
2. 無増悪生存期間 (主要評価項目)
| N | 中央値 | 95%信頼区間 | |
|---|---|---|---|
| PTX+Tmab群 | 44 | 3.2ヶ月 | 2.9-3.5 |
| PTX群 | 45 | 3.7ヶ月 | 2.8-4.5 |
HR 0.91 (95%信頼区間 0.67-1.22), p=0.33
3. 全生存期間
| N | 中央値 | 95%信頼区間 | |
|---|---|---|---|
| PTX+Tmab群 | 44 | 10.0ヶ月 | 7.6-13.1 |
| PTX群 | 45 | 10.2ヶ月 | 7.9-12.8 |
HR 1.23 (95%信頼区間 0.76-1.99), p=0.20
4. 奏効割合と病勢制御割合
| PTX群 (N=38) | PTX+Tmab群 (N=39) | p値 | |
|---|---|---|---|
| 奏効割合 (95%信頼区間) | 32% (17.5-48.7) | 33% (19.1-50.2) | 1.0 |
| 病勢制御割合 (95%信頼区間) | 71% (54.1-84.6) | 62% (44.6-76.6) | 0.47 |
5. 有効性に関するサブグループ解析
- 無増悪生存期間に関して、多くのサブグループでは有意な交互作用は認めなかったが、一次治療におけるTmab最終投与からの期間が30日以上の症例では、PTX+Tmab群で無増悪生存期間が延長する傾向を示した(HR 0.45, 95%信頼区間 0.21-0.96, 交互作用検定 p=0.022)。
- 一次治療におけるTmab最終投与からの期間が30日以上の症例では同様に、全生存期間(HR 0.56, 95%信頼区間 0.25-1.24)、奏効割合(38% vs 20%)に関してもPTX+Tmab群で良好な傾向を示した。
6. 投与状況と後治療
| PTX群 (N=45) | PTX+Tmab群 (N=44) | |
|---|---|---|
| PTXの投与回数 中央値 | 9回 | 9回 |
| Tmabの投与回数 中央値 | ― | 4.5回 |
| PTXの相対用量強度 中央値 | 59% | 60% |
| 増悪による治療中止, n (%) 有害事象による治療中止, n(%) |
31 (69) 8 (18) |
39 (89) 2 (5) |
| 三次治療施行例, n (%) IRI RAM タキサン系 Tmab併用, n (%) |
36 (80) n=32 n=13 n=10 6 (13) |
38 (86) n=32 n=12 n=11 9 (21) |
7. 有害事象 (CTCAE v4.0)
| N (%) | PTX群 (N=45) | PTX+Tmab群 (N=44) | ||
|---|---|---|---|---|
| 全Grade | Grade 3以上 | 全Grade | Grade 3以上 | |
| 白血球減少 | 25 (55.6) | 8 (17.8) | 32 (71.1) | 13 (28.9) |
| 好中球数減少 | 29 (64.4) | 12 (26.7) | 33 (73.3) | 15 (33.3) |
| 貧血 | 22 (48.9) | 11 (24.4) | 27 (60.0) | 14 (31.1) |
| 血小板数減少 | 4 (8.9) | 0 (0) | 3 (6.7) | 0 (0) |
| 悪心 | 9 (20.0) | 2 (4.4) | 9 (20.0) | 0 (0) |
| 食欲不振 | 13 (28.9) | 3 (6.7) | 21 (46.7) | 2 (4.4) |
| 下痢 | 10 (22.2) | 0 (0) | 11 (24.4) | 0 (0) |
| 口腔粘膜炎 | 3 (6.7) | 0 (0) | 7 (15.6) | 0 (0) |
| 疲労 | 17 (37.8) | 1 (2.2) | 14 (31.1) | 2 (4.4) |
| 発熱性好中球減少症 | 0 (0) | 0 (0) | 1 (2.2) | 1 (2.2) |
| 末梢性感覚ニューロパチー | 29 (64.4) | 3 (6.7) | 25 (55.6) | 3 (6.7) |
- 有害事象は両群間で近似していた。
- Tmabに関連する重篤な有害事象は認めなかった。
8. バイオマーカー解析
1) 腫瘍組織
- 一次治療終了後の腫瘍組織は18例(PTX+Tmab群 8例、PTX群 10例)で利用可能であった。
- HER2 IHC 3+, 2+, 1+, 0の症例は、それぞれ3(17%), 3(17%), 6(33%), 6(33%)であった。FISH法では18例中16例の腫瘍組織で解析可能であり、8例(50%)でFISH陽性と判定された。
- 以上から、一次治療終了後の腫瘍組織でHER2陽性と判定(HER2 3+, または2+かつFISH陽性)されたのは16例中5例(31%)のみであった。一次治療終了後の腫瘍組織でHER2陽性と判定された5例中2例がPTX+Tmab群に割り付けられ、1例で長期SD(9.4ヶ月)が得られた。
2) 血液検体
- プロトコール治療開始前に68例(PTX群 33例, PTX+Tmab群 35例)で血清検体が収集された。
- dPCR法を用いたcfDNA解析では、HER2増幅(cfHER2 amp)を41例(PTX群 21例, PTX+Tmab群 20例)に認めた。HER2増幅例においても両群間で無増悪生存期間、全生存期間共に差を認めなかった。
- 68例全例で血清中HER2細胞外ドメイン(sHER2 ECD)レベルが測定され、中央値は13.4ng/mlであった。中央値をカットオフ値として、中央値より高値と判定された35例のうち、20例(57%)がPTX群、15例(43%)がPTX+Tmab群に割り付けられていた。sHER2 ECD高値例においても両群間で無増悪生存期間、全生存期間共に差を認めなかった。
| N | 無増悪生存期間 HR (95%信頼区間) |
全生存期間 HR (95%信頼区間) |
||
|---|---|---|---|---|
| cfHER2 amp | 陰性 陽性 |
27 41 |
0.81 (0.36-1.85) 0.93 (0.49-1.76) |
1.19 (0.52-2.88) 1.44 (0.74-2.87) |
| sHER2 ECD | 中央値より低値 中央値より高値 |
33 35 |
0.97 (0.48-2.07) 0.83 (0.41-1.64) |
2.14 (0.97-5.09) 0.86 (0.41-1.75) |
結語
Tmabの継続投与はHER2陽性切除不能進行胃癌/胃食道接合部癌に対して、無増悪生存期間の改善を示すことができず、また有用な効果予測バイオマーカーを見出すことはできなかった。
関連論文
1) von Minckwitz G, et al. J Clin Oncol. 2009 Apr 20;27(12):1999-2006.
執筆:北海道大学病院 消化器内科 特任助教 原田 一顕 先生
監修:近畿大学医学部 内科学教室 腫瘍内科部門 医学部講師 川上 尚人 先生
監修:近畿大学医学部 内科学教室 腫瘍内科部門 医学部講師 川上 尚人 先生