| 対象疾患 | 治療ライン | 研究の相 | 評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 胃/食道胃接合部癌 | 一次治療 | 第3相 (サブ解析) |
有効性 安全性 |
国際 (本解析は日本のみ) |
あり |
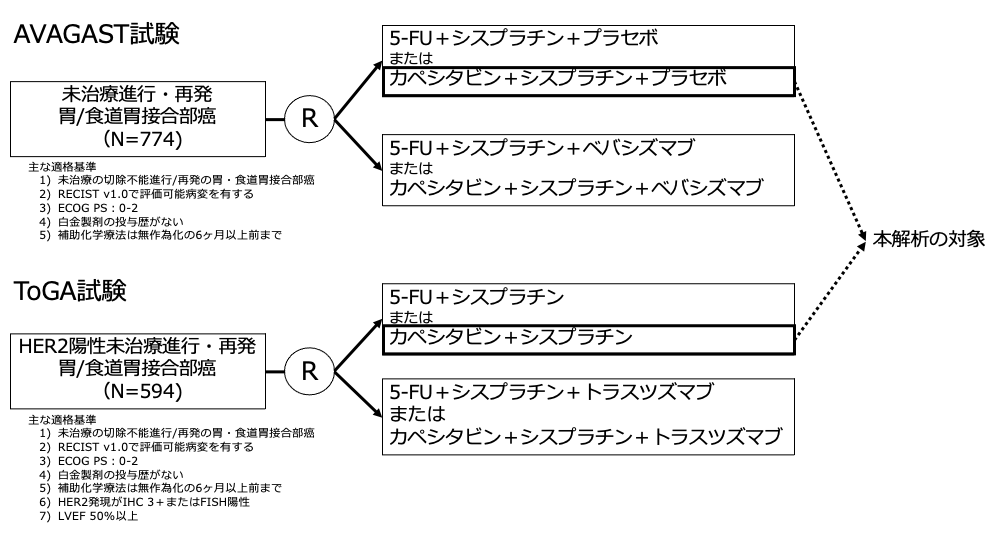
試験名 :AVAGAST / ToGA
レジメン:カペシタビン(Cape)+シスプラチン(CDDP)
登録期間:2007年9月〜2008年12月 / 2005年9月〜2008年12月
背景
化学療法は切除不能進行/転移性胃癌にとって最も効果的な治療法である。フッ化ピリミジン系薬剤(5-FUまたは経口フッ化ピリミジン製剤)+CDDP併用療法は有効性と安全性から一般的に最も使用されているレジメンの一つである。
Capeは経口フッ化ピリミジン製剤であり、5-FUとの有効性の比較について、海外で行われた2本の第3相比較試験であるREAL-2試験、ML17032試験において直接比較されている。これら2つの試験のメタ解析1)では、5-FUの組み合わせと比較してCapeの組み合わせは、より高い奏効割合(オッズ比 1.38、95%信頼区間 1.10–1.73)、および良好な全生存期間(HR 0.87、95%信頼区間 0.77–0.98)を示したことが報告されている。これらの結果から、Cape+CDDP併用療法(XP療法)は、転移性胃癌患者に対する標準的な一次化学療法の一つとして世界的に認められている。
AVAGAST試験2)、ToGA試験、EXPAND試験3)を含む最近の第3相試験では、XP療法に分子標的治療薬を併用することの有効性に焦点が当てられた(それぞれ、ベバシズマブ、トラスツズマブ、セツキシマブ)。AVAGAST試験およびToGA試験(HER2陽性胃癌患者で実施)は日本人を含む最初の国際共同試験であった。日本人症例はAVAGAST試験でXP療法を受けた387例中94例、ToGA試験でXP療法を受けた290例中50例が含まれていた。日本の胃癌治療ガイドライン(第3版)では、シスプラチン+S-1併用療法が、日本の標準的な一次治療レジメンとして推奨されているが、日本人集団におけるXP療法の有効性・安全性に関する情報は不十分であった。
本研究の目的はAVAGAST試験とToGA試験のサブグループデータを利用して、日本人の切除不能胃癌患者におけるXP療法の有効性と安全性を調査することであった。ToGA試験はHER2陽性患者を対象に実施されたが、化学療法の有効性がHER2過剰発現の有無によって異なるかどうかは不明であったため、ToGA試験とAVAGAST試験で別々に有効性を評価し、有害事象については両試験のデータを組み合わせて解析した。
Capeは経口フッ化ピリミジン製剤であり、5-FUとの有効性の比較について、海外で行われた2本の第3相比較試験であるREAL-2試験、ML17032試験において直接比較されている。これら2つの試験のメタ解析1)では、5-FUの組み合わせと比較してCapeの組み合わせは、より高い奏効割合(オッズ比 1.38、95%信頼区間 1.10–1.73)、および良好な全生存期間(HR 0.87、95%信頼区間 0.77–0.98)を示したことが報告されている。これらの結果から、Cape+CDDP併用療法(XP療法)は、転移性胃癌患者に対する標準的な一次化学療法の一つとして世界的に認められている。
AVAGAST試験2)、ToGA試験、EXPAND試験3)を含む最近の第3相試験では、XP療法に分子標的治療薬を併用することの有効性に焦点が当てられた(それぞれ、ベバシズマブ、トラスツズマブ、セツキシマブ)。AVAGAST試験およびToGA試験(HER2陽性胃癌患者で実施)は日本人を含む最初の国際共同試験であった。日本人症例はAVAGAST試験でXP療法を受けた387例中94例、ToGA試験でXP療法を受けた290例中50例が含まれていた。日本の胃癌治療ガイドライン(第3版)では、シスプラチン+S-1併用療法が、日本の標準的な一次治療レジメンとして推奨されているが、日本人集団におけるXP療法の有効性・安全性に関する情報は不十分であった。
本研究の目的はAVAGAST試験とToGA試験のサブグループデータを利用して、日本人の切除不能胃癌患者におけるXP療法の有効性と安全性を調査することであった。ToGA試験はHER2陽性患者を対象に実施されたが、化学療法の有効性がHER2過剰発現の有無によって異なるかどうかは不明であったため、ToGA試験とAVAGAST試験で別々に有効性を評価し、有害事象については両試験のデータを組み合わせて解析した。
シェーマ
[XP療法のスケジュール]
| AVAGAST試験 | Cape 1,000mg/m2 1日2回, 14日内服7日休薬 CDDP 80 mg/m2 Day 1 3週毎に最大6回繰り返す。以後は不応/不耐となるまでカペシタビン内服を繰り返す。 |
|---|---|
| ToGA試験 | Cape 1,000mg/m2 1日2回, 14日内服7日休薬 CDDP 80 mg/m2 Day 1 3週毎に最大6回繰り返す。 |
統計学的事項
全生存期間と無増悪生存期間の中央値はカプランマイヤー法を使用して推定され、95%信頼区間はBrookmeyer-Crowley法によって算出された。全奏効割合は確定した完全奏効(CR)または最良効果としての部分奏効(PR)の患者割合と定義した。
用量強度は、実際に投与された用量を計画された用量で割ったものとして定義された。 AVAGAST試験ではCDDPの計画用量は6サイクルすべての全用量、Capeの計画用量は実際に投与されたサイクルの全用量と規定された。ToGA研究の計画用量は実際の投与サイクルの全用量と規定された。
用量強度は、実際に投与された用量を計画された用量で割ったものとして定義された。 AVAGAST試験ではCDDPの計画用量は6サイクルすべての全用量、Capeの計画用量は実際に投与されたサイクルの全用量と規定された。ToGA研究の計画用量は実際の投与サイクルの全用量と規定された。
解析結果:
- AVAGAST試験:2007年9月から2008年12月までの間に17ヶ国 93施設から774例が登録された。日本人症例は14施設から188人が登録され、その内、XP群は94例であった。
- ToGA試験:2005年9月から2008年12月までの間に24ヶ国 122施設から594例が登録された。日本人症例は16施設から102人が登録されたが1例は治療を受けておらず、解析から除外され、101人が解析対象となった。その内、XP群は50例であった。
- 観察期間中央値:AVAGAST試験 12.0ヶ月(範囲 0.1-23.9)、ToGA試験 17.1ヶ月(範囲 1-49)
1. 患者背景
| N (%) | AVAGAST (N=94) | ToGA (N=50) | |
|---|---|---|---|
| 性別 | 男性 女性 |
63 (67.0) 31 (33.0) |
40 (80.0) 10 (20.0) |
| 年齢 | 中央値 (範囲) | 61.0 (36-78) | 63.5 (45-81) |
| 疾患状況 | 局所進行 転移性 |
1 (1.1) 93 (98.9) |
1 (2.0) 49 (98.0) |
| 原発部位 | 胃 食道胃接合部 |
88 (93.6) 6 (6.4) |
44 (88.0) 6 (12.0) |
| 病変の測定可能性 | 測定可能 測定不能 |
65 (69.1) 29 (30.9) |
41 (82.0) 9 (18.0) |
| ECOG PS | 0-1 | 94 (100.0) | 50 (100.0) |
| 登録時の転移臓器個数 | 0 1 2以上 1-2 3以上 |
1 (1.1) 34 (36.2) 59 (62.8) ― ― |
― ― ― 32 (64.0) 18 (36.0) |
| 組織型 | Intestinal type Diffuse type 混合型 |
22 (23.4) 65 (69.1) 7 (7.4) |
42 (84.0) 4 (8.0) 4 (8.0) |
| 血行性転移 | 肝転移 肝 or 肺転移 |
23 (24.5) ― |
— 33 (66.0) |
| 胃癌に対する治療歴 | 胃切除術 化学療法 |
31 (33.0) 8 (8.5) |
13 (26.0) 0 (0) |
2. 有効性評価
| AVAGAST (N=94) | ToGA (N=50) | |
|---|---|---|
| 全生存期間 中央値 (95%信頼区間) | 14.2ヶ月 (10.9-18.8) | 17.7ヶ月 (12.0-24.0) |
| 無増悪生存期間 中央値 (95%信頼区間) | 5.7ヶ月 (5.3-7.0) | 5.6ヶ月 (5.0-7.0) |
| 測定可能病変を有する症例 | 65例 | 41例 |
| 奏効割合 | 49.2% (32/65) | 58.5% (24/41) |
| 臨床的有効割合* | 67.7% (44/65) | 85.4% (35/41) |
| 増悪までの期間** 中央値 (95%信頼区間) | 5.6ヶ月 (5.1-7.2) | 5.6ヶ月 (5.0-7.0) |
| 奏効期間 中央値 (95%信頼区間) | 6.9ヶ月 (4.2-9.5) | 4.3ヶ月 (4.0-7.0) |
*臨床的有効割合:CR+PR+24週以上継続したSD の割合
**増悪までの期間:病勢進行した患者のみの増悪までの期間
3. 投与状況
| AVAGAST (N=94) | ToGA (N=50) | ||
|---|---|---|---|
| Cape | 投与サイクル 中央値 総投与量 中央値 用量強度 中央値 |
7 サイクル 243,900 mg 80 % |
6 サイクル 210,000 mg 84 % |
| CDDP | 投与サイクル 中央値 総投与量 中央値 用量強度 中央値 |
6 サイクル 539 mg 71 % |
6 サイクル 569 mg 83.3 % |
4. 有害事象 (CTCAE v3.0)
| N (%) | AVAGAST (n=94) | ToGA (N=50) | 計 (N=144) | |||
|---|---|---|---|---|---|---|
| 全Grade | Grade 3 | 全Grade | Grade 3 | 全Grade | Grade 3 | |
| 全有害事象 | 94 (100) | 71 (76) | 50 (100) | 36 (72) | 144 (100) | 107 (74) |
| 血液学的有害事象 好中球数減少 血小板数減少 貧血 発熱性好中球減少症 |
63 (67) 19 (20) 16 (17) 5 (5) |
45 (48) 2 (2) 10 (11) 5 (5) |
34 (68) 8 (16) 11 (22) 3 (6) |
20 (40) 3 (6) 8 (16) 3 (6) |
97 (67) 27 (19) 27 (19) 8 (6) |
65 (45) 5 (3) 18 (13) 8 (6) |
| 非血液学的有害事象 悪心 嘔吐 下痢 口腔粘膜炎 腹痛 手足の皮膚反応 皮疹 食欲不振 疲労 末梢神経障害 腎機能障害 流涙 |
84 (89) 60 (64) 51 (54) 34 (36) 12 (13) 54 (57) 19 (20) 83 (88) 69 (73) 28 (30) 17 (18) 2 (2) |
18 (19) 6 (6) 4 (4) 1 (1) 1 (1) 2 (2) ― 27 (29) 5 (5) 2 (2) 3 (3) ― |
44 (88) 28 (56) 24 (48) 16 (32) 3 (6) 23 (46) 5 (10) 46 (92) 26 (52) 10 (20) 27 (54) 1 (2) |
7 (14) 2 (4) 2 (4) 1 (2) ― 1 (2) ― 10 (20) 4 (8) ― ― ― |
128 (89) 88 (61) 75 (52) 50 (35) 15 (10) 77 (53) 24 (17) 129 (90) 95 (66) 38 (26) 44 (31) 3 (2) |
25 (17) 8 (6) 6 (4) 2 (1) 1 (<1) 3 (2) ― 37 (26) 9 (6) 2 (1) 3 (2) ― |
- 有害事象による治療中止:AVAGAST試験 12例(13%)、ToGA試験 4例(8%)
- 有害事象の事象内容と重症度は過去のXP療法の報告と近似していた。
- 治療関連死亡は認めなかった。
- AVAGAST試験では、好中球減少症の最初の発症までの期間の中央値は1.4ヶ月(サイクル3の開始時)、腎機能障害は21日(サイクル2の開始時)、悪心/嘔吐は3日(サイクル1でCDDPを投与した後)だった。
結語
Cape+CDDP併用療法は、日本人の進行再発胃/食道胃接合部癌に対して有効性を示し、忍容性も高く、日本人の切除不能胃癌患者に対する標準的な一次化学療法のレジメンの一つになり得る。
関連論文
1) Okines AFC, et al. Ann Oncol. 2009 Sep;20(9):1529-1534.
2) Ohtsu A, et al. J Clin Oncol. 2011 Oct 20;29(30):3968-76.
3) Lordick F, et al. Lancet Oncol. 2013 May;14(6):490-9.
執筆:香川大学医学部附属病院 がんセンター/腫瘍内科 病院講師 大北 仁裕 先生
監修:岐阜大学医学部附属病院 がんセンター 副センター長/准教授 牧山 明資 先生
監修:岐阜大学医学部附属病院 がんセンター 副センター長/准教授 牧山 明資 先生