| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 胃癌 | 一次治療 | 第3相 | 全生存期間 | 日本 | あり |
試験名 :JCOG1013
レジメン:シスプラチン+S-1 vsドセタキセル+シスプラチン+S-1
登録期間:2012年4月〜2016年3月
背景
無作為化比較試験であるJCOG9912試験によって、転移性胃癌患者に対して、S-1単剤療法が5-FU持続静注と同様の有効性であることが示され、その後、SPIRITS試験において、S-1単剤療法と比較し、シスプラチン+S-1併用療法(CS療法)の延命効果が示された。世界的にはシスプラチン+5-FU併用療法に対するカペシタビン+シスプラチン療法(XP療法)の非劣性が示され、さらに、オキサリプラチンは、ヨーロッパと日本【https://oncotribune.com/summary/stomach-cancer/g-sox へリンク】で行われた3つの第3相試験でシスプラチンと同様の有効性が示された。したがって、経口フッ化ピリミジン製剤+プラチナ併用療法は、進行胃癌患者に対する世界的な標準治療として確立されている。
2006年に報告された第3相試験であるV325試験1)は、二次治療の治療選択肢がほとんどなかった時代の試験であるが、進行胃癌患者に対して、5-FU+シスプラチン併用療法に対する3剤併用療法(ドセタキセル+シスプラチン+5-FU併用療法)の有意な生存延長を示した(生存期間中央値 9.2ヶ月 vs 8.6ヶ月)。しかし、3剤併用療法は重篤な血液学的有害事象の発生頻度が高く(Grade 3-4の好中球数減少 82%、発熱性好中球減少症 29%)、生存期間延長の優位性が小さいことから、標準治療として世界的に受け入れられていない。
ドセタキセル(40mg/m2)+シスプラチン(70mg/m2)+S-1(40mg/m2)併用療法(DCS療法[28日/サイクル×最大 6サイクル])の第2相試験2)では、高い有効性(奏効割合 81%、無増悪生存期間中央値 8.7ヵ月、生存期間中央値 18.5ヵ月)が報告された。このレジメンに関連するGrade 3-4の主な有害事象は好中球数減少(72%)、発熱性好中球減少症(14%)であり、有害事象により多くの症例でシスプラチンを60mg/m2に減量する必要があった。この結果を受けて、シスプラチンの用量調整を行ったDCS療法は切除不能胃癌における有効な治療になり得ると考え、DCS療法と標準治療であるCS療法との比較試験を実施した。
2006年に報告された第3相試験であるV325試験1)は、二次治療の治療選択肢がほとんどなかった時代の試験であるが、進行胃癌患者に対して、5-FU+シスプラチン併用療法に対する3剤併用療法(ドセタキセル+シスプラチン+5-FU併用療法)の有意な生存延長を示した(生存期間中央値 9.2ヶ月 vs 8.6ヶ月)。しかし、3剤併用療法は重篤な血液学的有害事象の発生頻度が高く(Grade 3-4の好中球数減少 82%、発熱性好中球減少症 29%)、生存期間延長の優位性が小さいことから、標準治療として世界的に受け入れられていない。
ドセタキセル(40mg/m2)+シスプラチン(70mg/m2)+S-1(40mg/m2)併用療法(DCS療法[28日/サイクル×最大 6サイクル])の第2相試験2)では、高い有効性(奏効割合 81%、無増悪生存期間中央値 8.7ヵ月、生存期間中央値 18.5ヵ月)が報告された。このレジメンに関連するGrade 3-4の主な有害事象は好中球数減少(72%)、発熱性好中球減少症(14%)であり、有害事象により多くの症例でシスプラチンを60mg/m2に減量する必要があった。この結果を受けて、シスプラチンの用量調整を行ったDCS療法は切除不能胃癌における有効な治療になり得ると考え、DCS療法と標準治療であるCS療法との比較試験を実施した。
シェーマ
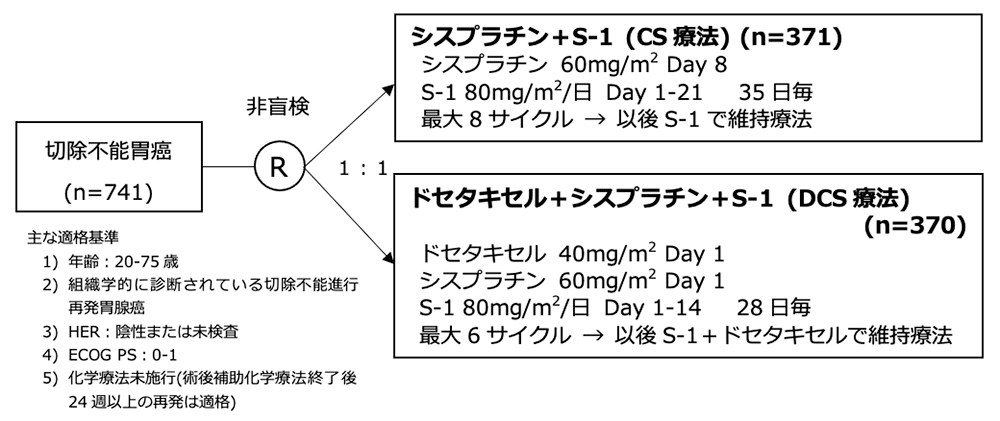
統計学的事項
主要評価項目:全生存期間(ITT集団)
本試験はCS療法に対するDCS療法の全生存期間における優越性を検証する試験として設計された。DCS群の生存期間中央値を16.5ヶ月、CS群の生存期間中央値を13.5ヶ月、検出力80%、片側α=0.05、4.5年間の登録期間、1.5年間の追跡期間を設定し、732人の登録、614のイベントが必要と想定された。脱落例を考慮し、目標登録症例数は740例と設定された。割付調整因子にはECOG PS(0 vs 1)、登録時の疾患状況(切除不能 vs 再発)、測定可能病変(あり vs なし)、転移臓器個数(0-1個 vs 2個以上)、組織型(分化型 vs 未分化型)が用いられた。
本試験は予定症例数の50%が登録された段階で中間解析が行われた。この中間解析では多重性を調整した後、主要評価項目の評価を実施した。中間解析で使用した有意水準は0.00029であり、最終解析における有意水準は0.04989となった。
試験結果:
- 2012年4月3日から2016年3月18日までの期間に日本国内56施設より741人が無作為割付けされた(DCS群:370人、CS群:371人)。
- CS群の1名は登録直前に胃切除が実施されており不適格となり、DCS群では3例(切除不能胃癌に対する化学療法歴 1例、登録前にHER2陽性が判明 1例、コントロール不能な糖尿病 1例)が不適格となった。これら4例の内、コントロール不能な糖尿病の1例を除いた3例はプロトコール治療を受けた。
- 有効性解析にはITT解析集団である全登録例741例が含められ、プロトコール治療が実施されなかった16例を除いた725例が安全性解析対象集団となった。
- 両群間の患者背景は、概ねバランスがとれていた。
- データカットオフ(2017年9月19日)時点における、88人の生存患者の観察期間中央値は30.9ヶ月(四分位範囲 23.6-41.1)であった。
1. 全生存期間(主要評価項目)
| N | イベント | 中央値 (95%信頼区間) |
1年生存割合 (95%信頼区間) |
2年生存割合 (95%信頼区間) |
|
|---|---|---|---|---|---|
| DCS | 370 | 322 | 14.2ヶ月 (12.9-15.9) |
59.7% (54.5-64.5) |
26.0% (21.6-30.6) |
| CS | 371 | 331 | 15.3ヶ月 (14.2-16.2) |
61.5% (56.3-66.2) |
24.2% (19.9-28.7) |
HR 0.99 (95%信頼区間 0.85-1.66), p=0.47(片側)
2. 組織型別の全生存期間
| 未分化型 | N | 中央値 | 95%信頼区間 |
|---|---|---|---|
| DCS | 241 | 13.3ヶ月 | 11.7-14.5 |
| CS | 241 | 14.2ヶ月 | 12.2-15.6 |
HR 0.98 (95%信頼区間 0.81-1.18), p=0.83
| 分化型 | N | 中央値 | 95%信頼区間 |
|---|---|---|---|
| DCS | 129 | 17.5ヶ月 | 14.0-20.4 |
| CS | 130 | 17.5ヶ月 | 15.0-20.6 |
HR 1.06 (95%信頼区間 0.81-1.39), p=0.65
| DCS+CS | N | 中央値 | 95%信頼区間 |
|---|---|---|---|
| 未分化型 | 482 | 13.7ヶ月 | 12.5-14.6 |
| 分化型 | 259 | 17.5ヶ月 | 15.7-18.9 |
HR 1.38 (95%信頼区間 1.17-1.62), p=0.0001 [単変量解析]
3. 無増悪生存期間
| N | 中央値 | 95%信頼区間 | |
|---|---|---|---|
| DCS | 370 | 7.4ヶ月 | 6.7-7.8 |
| CS | 371 | 6.5ヶ月 | 5.9-7.4 |
HR 0.99 (95%信頼区間 0.86-1.15), p=0.92
4. 奏効割合 (最良効果)
| N (%) | DCS (n=226) | CS (n=218) |
|---|---|---|
| CR PR SD PD NE |
2 (<1) 132 (58) 36 (16) 38 (17) 18 (8) |
0 122 (56) 19 (9) 54 (25) 23 (11) |
| 奏効割合 (95%信頼区間) |
59% (53-66) |
56% (49-63) |
- 奏効割合も両群間に有意差は認められなかった(p=0.50)。
5. 全生存期間に関するサブグループ解析
| CS (イベント/N) |
DCS (イベント/N) |
HR (95%信頼区間) | P値 (交互作用) |
|
|---|---|---|---|---|
| 組織型 分化型 未分化型 |
111/130 220/241 |
108/129 214/241 |
1.06 (0.81-1.39) 0.98 (0.81-1.18) |
0.71 |
| ECOG PS 0 1 |
212/241 119/130 |
199/239 123/131 |
0.98 (0.81-1.20) 1.02 (0.79-1.31) |
0.78 |
| 年齢 65歳以下 66歳以上 |
190/206 141/165 |
172/193 150/177 |
0.97 (0.79-1.19) 1.03 (0.82-1.30) |
0.65 |
| 性別 男性 女性 |
226/256 105/115 |
223/257 99/113 |
0.98 (0.81-1.17) 1.07 (0.81-1.41) |
0.53 |
| 転移臓器個数 0-1 2以上 |
132/157 199/214 |
133/157 189/213 |
1.07 (0.84-1.37) 0.96 (0.78-1.17) |
0.50 |
| 腹膜播種 なし あり |
147/168 184/203 |
154/184 168/186 |
0.98 (0.78-1.23) 1.02 (0.83-1.26) |
0.79 |
| 測定可能病変 なし あり |
135/153 196/218 |
128/144 194/226 |
1.09 (0.85-1.39) 0.95 (0.78-1.15) |
0.37 |
| 胃切除歴 なし あり |
261/293 70/78 |
261/293 61/77 |
1.14 (0.96-1.36) 0.64 (0.45-0.90) |
0.004 |
| 術後補助化学療法 なし あり |
300/338 31/33 |
288/328 34/42 |
1.07 (0.91-1.26) 0.51 (0.30-0.85) |
0.020 |
- 術後補助化学療法歴がある症例ではDCS群において良好な結果が得られ、有意な交互作用を示した。
| 術後補助化学療法歴:あり | N | イベント | 中央値 | 95%信頼区間 |
|---|---|---|---|---|
| DCS | 42 | 34 | 19.5ヶ月 | 13.7-30.5 |
| CS | 33 | 31 | 14.1ヶ月 | 9.4-17.7 |
非層別HR 0.51 (95%信頼区間 0.30-0.85)
| 術後補助化学療法歴:なし | N | イベント | 中央値 | 95%信頼区間 |
|---|---|---|---|---|
| DCS | 328 | 288 | 13.8ヶ月 | 12.5-15.7 |
| CS | 338 | 300 | 15.4ヶ月 | 14.2-16.2 |
非層別HR 1.07 (95%信頼区間 0.91-1.26)
- 胃切除歴の有無も同様の交互作用が示された。
6. 投与状況
- 投与サイクル数の中央値:DCS群 6サイクル(四分位範囲 4-10)、CS群 4サイクル(四分位範囲 3-7)
- DCS群における相対用量強度:S-1 71.5%、シスプラチン 66.6%、ドセタキセル 86.7%
- CS群における相対用量強度:S-1 76.8%、シスプラチン 88.1%
- DCS群において減量を要した症例:シスプラチン 262例(73%)、S-1 222例(62%)、ドセタキセル 195例(54%)
- CS群において減量を要した症例:シスプラチン 131例(36%)、S-1 138例(38%)
- 治療中止理由として最多は病勢進行(DCS群 254例[69%]、CS群 270例[73%])であり、続いて有害事象(DCS群 40例[11%]、CS群 39例[11%])であった。
- 治療関連有害事象による治療拒否はDCS群 34例(9%)、CS群 29例(8%)に観察された。
- プロトコール治療終了後の二次治療投与状況は下記の通り。
| N (%) | DCS (n=370) | CS (n=371) |
|---|---|---|
| 二次治療 | 284 (77) | 294 (79) |
| イリノテカン タキサン系 ラムシルマブ |
116 (31) 106 (29) 21 (6) |
50 (13) 227 (61) 61 (16) |
7. 有害事象 (CTCAE v4.0)
| N (%) | CS (n=367) | DCS (n=358) | ||||
|---|---|---|---|---|---|---|
| Grade 1-2 | Grade 3 | Grade 4 | Grade 1-2 | Grade 3 | Grade 4 | |
| 白血球減少 | 175 (48) | 45 (12) | 15 (4) | 166 (46) | 110 (31) | 10 (3) |
| 貧血 | 271 (74) | 71 (19) | 18 (5) | 271 (76) | 67 (19) | 16 (5) |
| 血小板数減少 | 233 (64) | 24 (7) | 7 (2) | 235 (66) | 12 (3) | 2 (<1) |
| 好中球数減少 | 179 (49) | 81 (22) | 36 (10) | 112 (31) | 120 (34) | 89 (25) |
| 低アルブミン血症 | 342 (94) | 15 (4) | - | 341 (96) | 11 (3) | - |
| 血中ビリルビン増加 | 46 (13) | 3 (<1) | 0 (0) | 29 (8) | 3 (<1) | 0 (0) |
| クレアチニン増加 | 138 (38) | 2 (<1) | 2 (<1) | 126 (35) | 2 (<1) | 1 (1<) |
| 低ナトリウム血症 | 267 (73) | 43 (12) | 2 (<1) | 261 (73) | 49 (14) | 2 (<1) |
| 疲労 | 212 (58) | 42 (11) | - | 203 (57) | 40 (11) | - |
| 食欲不振 | 230 (63) | 81 (22) | 0 (0) | 218 (61) | 94 (26) | 0 (0) |
| 悪心 | 208 (57) | 27 (7) | - | 214 (60) | 31 (9) | - |
| 嘔吐 | 81 (22) | 9 (2) | 0 (0) | 83 (23) | 8 (2) | 0 (0) |
| 下痢 | 123 (34) | 27 (7) | 0 (0) | 149 (42) | 25 (7) | 0 (0) |
| 口腔粘膜炎 | 84 (23) | 8 (2) | 0 (0) | 120 (34) | 9 (3) | 0 (0) |
| 末梢性感覚ニューロパチー | 51 (14) | 0 (0) | 0 (0) | 67 (19) | 0 (0) | 0 (0) |
| 脱毛症 | 42 (11) | - | - | 260 (73) | - | - |
- G-CSFはDCS群 62例(17%)、CS群 35例(10%)に投与された。
- 治療関連死亡は、DCS群で3例(血栓塞栓症、心筋梗塞、肺炎・呼吸機能不全)、CS群で1例(肺炎)に認めた。
結語
化学療法未施行の日本人進行胃癌症例に対して、CS療法に対するドセタキセルの上乗せは生存期間の有意な延長を示さず、CS療法が引き続き、標準的一次化学療法と考えられる。
関連論文
1) Van Cutsem E, Moiseyenko VM, Tjulandin S, et al. Phase III study of docetaxel and cisplatin plus fluorouracil compared with cisplatin and fluorouracil as first-line therapy for advanced gastric cancer: a report of the V325 Study Group. J Clin Oncol. 2006 Nov 1;24(31):4991-7.
2) Koizumi W, Nakayama N, Tanabe S, et al. A multicenter phase II study of combined chemotherapy with docetaxel, cisplatin, and S-1 in patients with unresectable or recurrent gastric cancer (KDOG 0601). Cancer Chemother Pharmacol. 2012 Feb;69(2):407-13.
執筆:大阪医療センター 消化器内科 医師 長谷川 裕子 先生
監修:岐阜大学医学部附属病院 がんセンター 副センター長/准教授 牧山 明資 先生
監修:岐阜大学医学部附属病院 がんセンター 副センター長/准教授 牧山 明資 先生