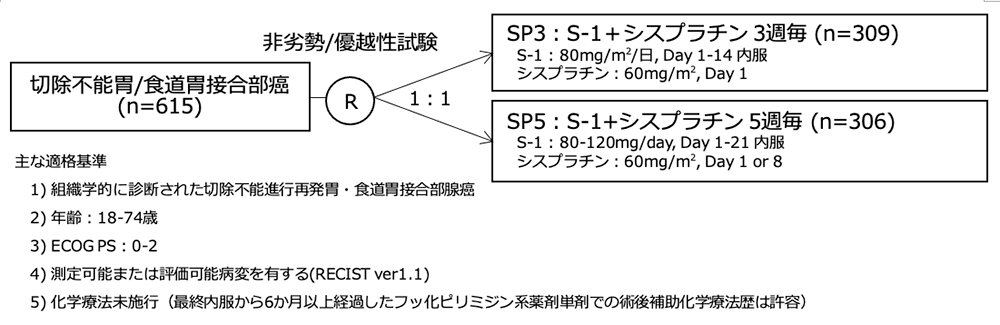
| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 胃/食道胃接合部癌 | 一次治療 | 第3相 | 無増悪生存期間(中央判定) | 日本・韓国 | あり |
試験名 :SOS
レジメン:S-1+シスプラチン (5週毎) vs S-1+シスプラチン (3週毎)
登録期間:2009年2月〜2012年1月
背景
切除不能・進行再発胃癌に対する一次治療として、静注5-FU+シスプラチン(±エピルビシン)が一般的に使用されるが、近年の第3相試験(REAL-2試験, ML17032試験)より経口フッ化ピリミジン製剤(S-1やカペシタビン)が静注5-FUに代替可能であることが示された。
S-1+シスプラチン併用療法(SP)の投与スケジュールは多様であり、地域差が存在する。日本ではSPIRITS試験に基づき、5週毎のS-1+シスプラチン療法(SP5)[S-1 80-120mg/day, Day 1-21内服、シスプラチン 60mg/m2, Day 8) が標準的一次治療レジメンとして受け入れられている。一方、韓国では経口フッ化ピリミジン製剤を含む他の標準的なレジメンが3週間毎に投与されるという一般的な慣行に従って、3週毎のS-1+シスプラチン療法(SP3)[S-1 80mg/m2, Day 1-14内服、シスプラチン 60mg/m2, Day 1投与) が開発された。SP5ではシスプラチンの用量強度が低くなるため、SP3と比較して効果が劣る可能性が危惧されていた。さらに、これらのスケジュールの違いにより、新規薬剤を併用する国際共同試験の計画と実施が、東アジアにおいてでさえ困難になる可能性があった。
したがって、S-1+シスプラチン併用療法の最適な投与スケジュールについてのコンセンサスを必要としたため、東アジアにおける切除不能・進行再発胃癌に対する一次治療として、SP3とSP5を比較する多施設共同無作為化比較第3相試験(S-1 Optimal Schedule Study:SOS試験)が実施された。
S-1+シスプラチン併用療法(SP)の投与スケジュールは多様であり、地域差が存在する。日本ではSPIRITS試験に基づき、5週毎のS-1+シスプラチン療法(SP5)[S-1 80-120mg/day, Day 1-21内服、シスプラチン 60mg/m2, Day 8) が標準的一次治療レジメンとして受け入れられている。一方、韓国では経口フッ化ピリミジン製剤を含む他の標準的なレジメンが3週間毎に投与されるという一般的な慣行に従って、3週毎のS-1+シスプラチン療法(SP3)[S-1 80mg/m2, Day 1-14内服、シスプラチン 60mg/m2, Day 1投与) が開発された。SP5ではシスプラチンの用量強度が低くなるため、SP3と比較して効果が劣る可能性が危惧されていた。さらに、これらのスケジュールの違いにより、新規薬剤を併用する国際共同試験の計画と実施が、東アジアにおいてでさえ困難になる可能性があった。
したがって、S-1+シスプラチン併用療法の最適な投与スケジュールについてのコンセンサスを必要としたため、東アジアにおける切除不能・進行再発胃癌に対する一次治療として、SP3とSP5を比較する多施設共同無作為化比較第3相試験(S-1 Optimal Schedule Study:SOS試験)が実施された。
シェーマ
統計学的事項
主要評価項目:無増悪生存期間 (中央判定)
本試験の主要評価項目は独立評価委員会判定による無増悪生存期間とされ、副次的評価項目は主治医判定による無増悪生存期間、奏効割合、全生存期間、有害事象、EQ-5DによるQOLとされた。本試験では無増悪生存期間に関して、SP3群のSP5群に対する非劣性と優越性を検証するハイブリッドデザインが採用された。SP5群の無増悪生存期間中央値を6ヶ月と推定し、非劣勢検証においてはSP5群に対するSP3群の非劣性マージンをHR 1.15と設定し、片側α=0.025、検出力 80%として必要症例数を560例と算定した。脱落率を10%として622例を目標症例数と設定した。優越性検証については560例のサンプルサイズを使用して、無増悪生存期間中央値 1.5ヵ月の上乗せ (6ヵ月 vs. 7.5ヵ月) を検証することとした (片側α=0.05、検出力 85%)。
本試験では332イベントが発生した段階で有効性の中間解析を実施することを計画し、有効中止基準を両側α=0.0052と設定した。最終解析は516イベント発生時、または最終症例登録後1年のいずれか早いタイミングで行うこととし、中間解析を調整し、両側α=0.042でログランク検定を実施した。
試験結果:
- 2009年2月18日から2012年1月31日までの間に、日本/韓国の42施設から625例が登録され、無作為割り付けされた。適格規準違反が明らかとなった10例を除外し、最終的な解析対象は615例(SP3群 309例/SP5群 306例)であった。
- 患者背景は両群間でバランスがとれていた。
- 独立評価委員会が事前に計画された中間解析を行い、研究継続を推奨した(2011年10月4日)。
- 本試験のデータロックは2013年1月31日に実施され、この時点で研究者判定による増悪イベントは447件(SP3 210, SP5 237)であり、その後、盲検化された中央判定にて420件(SP3 198, SP5 222)が確認された。この時点で生存例の観察期間中央値は32.4ヵ月(範囲:13.3–48.6ヵ月)であった。
1. 独立評価委員会判定による無増悪生存期間 (主要評価項目)
| N | 中央値 | 95%信頼区間 | |
|---|---|---|---|
| SP3 | 306 | 5.5ヶ月 | 4.7-6.6 |
| SP5 | 309 | 4.9ヶ月 | 4.2-5.5 |
HR 0.82 (95%信頼区間 0.68-0.99), p=0.0418
- HRの95%信頼区間上限が事前に規定した非劣性マージン 1.15を下回ったため、SP3群のSP5群に対する非劣性が証明された。
- 優越性の検証においてもSP3群はSP5群と比較し、無増悪生存期間を有意に延長することが示された。
2. 主治医判定による無増悪生存期間
| N | 中央値 | 95%信頼区間 | |
|---|---|---|---|
| SP3 | 306 | 5.5ヶ月 | 5.1-6.2 |
| SP5 | 309 | 4.2ヶ月 | 4.1-5.5 |
HR 0.80 (95%信頼区間 0.66-0.96), p=0.019
3. 無増悪生存期間に関するサブグループ解析
| HR (95%信頼区間) | P値(交互作用) | |
|---|---|---|
| 年齢 60歳未満 (n=316) 60歳以上 (n=299) |
0.75 (0.58-0.97) 0.94 (0.70-1.25) |
0.260 |
| 性別 男性 (n=464) 女性 (n=151) |
0.84 (0.67-1.05) 0.79 (0.54-1.15) |
0.760 |
| ECOG PS 0 (n=118) 1 (n=484) 2 (n=13) |
0.90 (0.56-1.42) 0.82 (0.66-1.01) 0.57 (0.19-2.88) |
0.458 |
| 登録時疾患状態 初発時転移 (n=513) 再発 (n=82) 転移切除後 (n=20) |
0.84 (0.68-1.03) 0.79 (0.44-1.41) 0.58 (0.19-1.76) |
0.525 |
| 分化度 高分化型 (n=34) 中分化型 (n=194) 低分化型 (n=306) |
1.01 (0.41-2.48) 0.70 (0.49-0.99) 0.82 (0.63-1.07) |
0.569 |
| 測定可能病変 あり (n=380) なし (n=235) |
0.86 (0.63-1.08) 0.73 (0.50-1.05) |
0.471 |
| 国 韓国 (n=512) 日本 (n=103) |
0.78 (0.63-0.96) 1.12 (0.69-1.81) |
0.155 |
- 日本人症例では、SP5群で良好な傾向がありましたが、統計学的有意差はなかった。
- 化学療法の有効性と患者背景との間に有意な交互作用はなかった。
4. 全生存期間
| N | 中央値 | 95%信頼区間 | |
|---|---|---|---|
| SP3 | 306 | 14.1ヶ月 | 11.4-15.8 |
| SP5 | 309 | 13.9ヶ月 | 11.6-15.9 |
HR 0.99 (95%信頼区間 0.81-1.21), p=0.91
5. 奏効割合/病勢制御割合
| N (%) | SP3 (n=306) | SP5 (n=309) | p値 |
|---|---|---|---|
| 測定可能病変を有する症例 | 191 (62) | 189 (61) | ― |
| CR PR SD PD NE |
1 (1) 113 (59) 51 (27) 21 (11) 5 (3) |
1 (1) 94 (50) 52 (28) 37 (20) 5 (3) |
|
| 奏効割合 | 114 (60) | 95 (50) | 0.065 |
| 病勢制御割合 | 165 (86) | 147 (78) | 0.029 |
6. 投与状況
- 投与回数中央値:SP3群 5サイクル(範囲:0-49)、SP5群 3サイクル(範囲:0-25)
- S-1の減量を要した症例数:SP3群 n=159、SP5群 n=66
- シスプラチンの減量を要した症例数:SP3群 n=59、SP5群 n=26
- シスプラチンの投与中止に至った症例数:SP3群 n=45、SP5群 n=31
- サイクル開始に延期を要した症例数:SP3群 n=213、SP5群 n=129
- S-1の用量強度中央値:SP3群 331 mg/m2/週 vs SP5群 317 mg/m2/週, p<0.001
- シスプラチンの用量強度中央値:SP3群 18 mg/m2/週 vs SP5群 12 mg/m2/週, p<0.001
7. ドセタキセル、パクリタキセル、イリノテカンを含む後治療移行割合
| N | 二次治療移行症例 | 三次治療移行症例 | |
|---|---|---|---|
| SP3 | 306 | 163 (53) | 89 (29) |
| SP5 | 309 | 166 (54) | 100 (32) |
| p値 | ― | 0.91 | 0.38 |
8. 10%以上の症例に生じた有害事象 (CTCAE v3.0)
| N (%) | SP3 (n=303) | SP5 (n=303) | p値 | |||
|---|---|---|---|---|---|---|
| 全Grade | Grade 3-4 | 全Grade | Grade 3-4 | 全Grade | Grade 3-4 | |
| 1つ以上の有害事象が生じた症例 | 296 (98) | 220 (73) | 294 (97) | 153 (50) | 0.612 | <0.001 |
| ヘモグロビン | 283 (93) | 57 (19) | 261 (86) | 28 (9) | 0.003 | 0.001 |
| 好中球 | 238 (79) | 118 (39) | 124 (41) | 27 (9) | <0.001 | <0.001 |
| 血小板 | 188 (62) | 30 (10) | 115 (38) | 20 (7) | <0.001 | 0.140 |
| 食欲不振 | 191 (63) | 26 (9) | 174 (57) | 21 (7) | 0.158 | 0.448 |
| 悪心 | 151 (50) | 15 (5) | 146 (48) | 8 (3) | 0.685 | 0.137 |
| 嘔吐 | 82 (27) | 12 (4) | 87 (29) | 11 (4) | 0.651 | 0.832 |
| 下痢 | 87 (29) | 9 (3) | 80 (26) | 12 (4) | 0.525 | 0.505 |
| 便秘 | 90 (30) | 1 (0.3) | 84 (28) | 1 (0.3) | 0.590 | 1.000 |
| 腹痛 | 99 (33) | 13 (4) | 94 (31) | 9 (3) | 0.663 | 0.385 |
| 疲労 | 163 (54) | 24 (8) | 150 (50) | 26 (9) | 0.291 | 0.768 |
| めまい | 43 (14) | 1 (0.3) | 31 (10) | 1 (0.3) | 0.137 | 1.000 |
| 体重減少 | 58 (19) | 2 (0.7) | 39 (13) | 3 (1) | 0.035 | 1.000 |
| 色素沈着 | 33 (11) | 0 (0) | 33 (11) | 0 (0) | 1.000 | - |
| 神経障害:感覚性 | 75 (25) | 4 (1) | 55 (18) | 0 (0) | 0.048 | 0.124 |
| ビリルビン | 98 (32) | 8 (3) | 60 (20) | 6 (2) | <0.001 | 0.589 |
| クレアチニン | 38 (13) | 0 (0) | 25 (8) | 4 (1) | 0.084 | 0.124 |
- SP5群と比し、SP3群でGrade3 以上の有害事象が有意に多く発現した(73% vs 51%)。
- 発熱性好中球減少症はSP3群で7名(2%)、SP5群で3名(1%)に発症した(p=0.22)。
- 各群でそれぞれ1例の治療関連死亡認められた(SP3:腎不全/SP5:感染)
9. Quality of life (QOL)評価
- 試験治療開始前、及び6週毎にEuropean Quality-of-Life Group (EuroQol) 5-item questionnaire (EQ-5D)を用いて評価された。
- 治療開始前、6週、12週、18週、24週で、それぞれ、615、481、359、286、及び202例の評価が可能であった。
- 治療開始前のQOL評価では両群間に差はなかった。
- 「移動の程度」の悪化は、6週(13% vs 8%; p=0.007)、及び12週(21% vs 10%; p=0.024)でSP5群に比し、SP3群でより顕著であった。一方、「痛み/不快感」の悪化は、12週(21% vs 14%; p=0.027)、及び24週(26% vs 18%; p=0.023)でSP3群に比し、SP5群でより顕著であった。
- その他の項目では両群間に差はなかった。
結語
SP3はSP5と比較し、無増悪生存期間を延長したが、その改善はごく僅かであり、全生存期間には差を認めなかったため、進行胃癌患者の一次治療としてSP3とSP5の両者が推奨される。
執筆:北海道大学病院 消化器内科 特任助教 原田 一顕 先生
監修:岐阜大学医学部附属病院 がんセンター 副センター長/准教授 牧山 明資 先生
監修:岐阜大学医学部附属病院 がんセンター 副センター長/准教授 牧山 明資 先生