| 対象疾患 | 治療ライン | 研究の相 | 評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| HER2陽性胃癌/食道胃接合部癌 | 一次治療 | 第2相 | 奏効割合 | 韓国 | なし |
試験名 :なし (XELOX+トラスツズマブ)
レジメン:カペシタビン+オキサリプラチン+トラスツズマブ
登録期間:2011年8月6日〜2013年2月23日
背景
HER2過剰発現もしくは増幅が胃癌患者の6-36%に認められることから、HER2過剰発現を有する化学療法未施行例を対象とした無作為化比較第3相試験であるToGA試験において、HER2に対するモノクローナル抗体であるトラスツズマブ(T-mab)の有効性が検証された。その結果、化学療法にT-mabを併用することで生存期間中央値が2.7ヶ月の延長を示し、T-mabは胃癌治療において初めて承認された分子標的治療薬となった。以上の結果より、殺細胞性抗がん剤とT-mabの併用療法がHER2陽性胃癌に対する標準治療と考えられている。
転移性/切除不能胃癌に対する標準的化学療法レジメンは1つではなく、フッ化ピリミジン系および白金製剤を含む2剤併用もしくは3剤併用レジメンが標準治療と見なされている。過去の無作為化比較第3相試験では持続静注5-FU・シスプラチン(CDDP)に対するカペシタビン(Cape)・オキサリプラチン(OX)の非劣性が示され(REAL-2試験、ML17032試験)、現在、Cape/OXがそれぞれ5-FU持続静注/CDDPの代替として使用できることが広く受け入れられており、同等の有効性と異なる安全性プロファイルが期待されている。
ToGA試験ではT-mabと併用する化学療法としてCape+CDDP併用療法(XP)、または5-FU+CDDP(FP)が選択可能だったが、88%の症例でXPが選択されていた。しかし、胃癌の様々な標準レジメンの中で、有効性と安全性の観点からどの化学療法がトラスツズマブとの併用に最適であるかは依然として不明である。Cape+OX併用療法(XELOX)は転移性/切除不能胃癌に対する標準的化学療法の一つであり、探索的解析を含む先行研究ではOX併用レジメンは、CDDP併用レジメンと比較して、良好な安全性プロファイルと潜在的に良好な有効性を示した。しかし、XELOX+T-mab併用療法について検討した試験はなく、HER2陽性進行胃癌に対するXELOX+T-mab併用療法の有効性と安全性を評価するため、多施設共同第2相試験が行われた。
転移性/切除不能胃癌に対する標準的化学療法レジメンは1つではなく、フッ化ピリミジン系および白金製剤を含む2剤併用もしくは3剤併用レジメンが標準治療と見なされている。過去の無作為化比較第3相試験では持続静注5-FU・シスプラチン(CDDP)に対するカペシタビン(Cape)・オキサリプラチン(OX)の非劣性が示され(REAL-2試験、ML17032試験)、現在、Cape/OXがそれぞれ5-FU持続静注/CDDPの代替として使用できることが広く受け入れられており、同等の有効性と異なる安全性プロファイルが期待されている。
ToGA試験ではT-mabと併用する化学療法としてCape+CDDP併用療法(XP)、または5-FU+CDDP(FP)が選択可能だったが、88%の症例でXPが選択されていた。しかし、胃癌の様々な標準レジメンの中で、有効性と安全性の観点からどの化学療法がトラスツズマブとの併用に最適であるかは依然として不明である。Cape+OX併用療法(XELOX)は転移性/切除不能胃癌に対する標準的化学療法の一つであり、探索的解析を含む先行研究ではOX併用レジメンは、CDDP併用レジメンと比較して、良好な安全性プロファイルと潜在的に良好な有効性を示した。しかし、XELOX+T-mab併用療法について検討した試験はなく、HER2陽性進行胃癌に対するXELOX+T-mab併用療法の有効性と安全性を評価するため、多施設共同第2相試験が行われた。
シェーマ
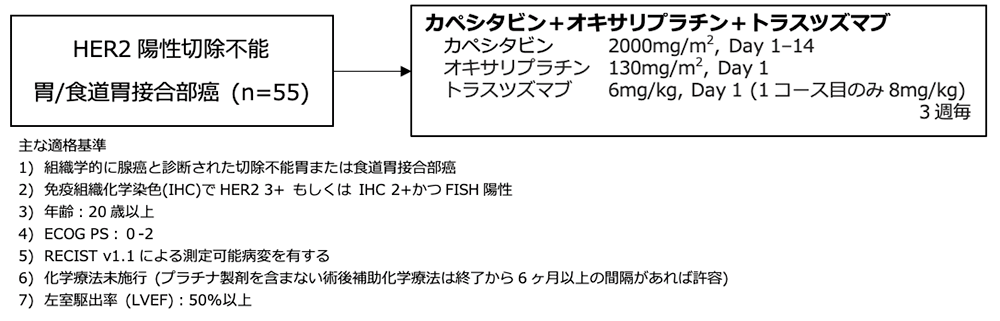
統計学的事項
主要評価項目:奏効割合 (担当医評価)
Simonの二段階デザインに基づいて症例数が設定された。既報からXELOX療法の奏効割合を40%と設定し、トラスツズマブの併用により15%の上昇を期待した。両側α=0.1、検出力80%とし、10%の脱落を見込み、必要症例数は55例と算出された。第1ステージは30例で検討を予定し、11例以上の奏効が得られた場合、第2ステージに進む事とされた。
試験結果:
- 2011年8月6日から2013年2月23日の間に64例がスクリーニングを受けたが、8例は適格基準を満たさず、1例は中央病理判定でHER2陽性が確認されなかったため55例が適格となった。
- 最終解析のデータカットオフは2013年9月2日であり、この段階で16例が治療継続中であり、39例が治療中止となっていた(病勢進行 31例、同意撤回 4例、根治切除へ移行 2例、追跡不能 1例、有害事象 1例)。
1. 患者背景
| N (%) | N=55 | |
|---|---|---|
| 年齢(歳) | 中央値 (範囲) | 57 (29-74)) |
| 性別 | 男性 | 37 (66) |
| ECOG PS | 0-1 | 51 (93) |
| 疾患状態 | 根治切除後の再発 初診時より転移性 局所進行 (切除不能) |
8 (14) 45 (82) 2 (4) |
| HER2 status (中央病理判定) | IHC 2+ かつ FISH陽性 IHC 3+ |
6 (11) 49 (89) |
| 転移臓器 | いずれか 肝 腹膜 肺 骨 リンパ節転移 |
53 (96) 27 (49) 15 (27) 11 (20) 7 (13) 42 (76) |
2. 奏効割合 (主要評価項目、担当医評価)・病勢制御割合
| n=55 | 95%信頼区間 | |
|---|---|---|
| CR PR SD PD NE |
2 (4%) 35 (64%) 12 (21%) 3 (5%) 3 (5%) |
― |
| 奏効割合 | 68% | (54-80) |
| 病勢制御割合 | 89% | (78-95) |
- 著明な縮小、及び遠隔転移の完全消失を示した2例に対して原発切除が行われ、これら2名は切除病理組織において残存病変は認めなかった。
- 3例で画像評価を実施できなかった (1サイクル後に治療継続拒否 2例、初回評価前の早期死亡 1例)。
- 中央判定における奏効割合:69%
3. 無増悪生存期間 (担当医評価)
| N | 中央値 | (95%信頼区間) | 6ヶ月無増悪生存割合 |
|---|---|---|---|
| 55 | 9.8ヶ月 | (7.0-12.6) | 69% |
- 観察期間中央値:13.8ヶ月 (範囲:6.1-23.9)
- 中央判定における無増悪生存期間:中央値 8.6ヶ月 (95%信頼区間 7.4-9.9)
4. 全生存期間
| N | 中央値 | (95%信頼区間) | 1年生存割合 |
|---|---|---|---|
| 55 | 21.0ヶ月 | (6.4-35.7) | 63% |
5. 後治療
- 病勢進行にて試験治療を中止した29例の内、22例が二次化学療法を受けた。治療の内訳は6例が抗HER2療法、1例がmTOR阻害薬、15例が従来の化学療法であった。
6. 投与状況
- 投与サイクル中央値:Cape 10サイクル(範囲:1-30)、OX 8サイクル(範囲:1-30)、T-mab 10サイクル(範囲:1-30)
- 7サイクルまでの平均相対用量強度(RDI):Cape 74%、OX78%、T-mab 90%
7. 10%以上の症例に発生した有害事象 (CTCAE ver4.03)
| N (%) | Grade 1 | Grade 2 | Grade 3 | Grade 4 |
|---|---|---|---|---|
| 好中球数減少 | 4 (7) | 17 (31) | 10 (18) | 0 (0) |
| 貧血 | 24 (47) | 23 (42) | 5 (9) | 1 (2) |
| 血小板数減少 | 28 (51) | 7 (13) | 1 (2) | 1 (2) |
| 白血球減少 | 16 (29) | 11 (20) | 0 (0) | 0 (0) |
| 食欲不振 | 20 (36) | 9 (16) | 2 (4) | 0 (0) |
| 悪心 | 22 (40) | 7 (13) | 1 (2) | − |
| 嘔吐 | 9 (16) | 9 (16) | 0 (0) | 0 (0) |
| 下痢 | 15 (27) | 5 (9) | 1 (2) | 0 (0) |
| 便秘 | 14 (25) | 3 (5) | 0 (0) | 0 (0) |
| 口腔粘膜炎 | 10 (18) | 1 (2) | 1 (2) | 0 (0) |
| 腹痛 | 16 (29) | 5 (9) | 0 (0) | − |
| 疲労 | 15 (27) | 12 (22) | 3 (5) | − |
| 末梢性感覚ニューロパチー | 22 (40) | 11 (20) | 6 (11) | 0 (0) |
| 手掌・足底発赤知覚不全症候群 | 11 (20) | 6 (11) | 1 (2) | − |
| 皮膚色素過剰 | 22 (40) | 0 (0) | − | − |
| 体重減少 | 6 (11) | 2 (4) | 0 (0) | − |
- 治療関連死亡:重篤な下痢と複雑な敗血症 (n=1)
- 治療開始後に心不全を発症した症例はいなかった。時間経過に伴う左室駆出率の統計学的に有意な変化は認めず、治療開始前と比較して10%以上の減少を示した症例もいなかった。
| 左室駆出率 | 治療開始前 | 3ヶ月 | 6ヶ月 | 9ヶ月 | 12ヶ月 |
|---|---|---|---|---|---|
| 平均値±標準偏差 (範囲) |
67.7±5.2% (55-79) |
67.1±4.8% (57-78) |
65.9±4.4% (58-76) |
66.2±4.5% (60-78) |
66.6±5.0% (60-83) |
結語
Cape+OX+T-mab併用療法はHER2陽性進行胃/食道胃接合部腺癌に対して、忍容性があり、高い有効性を示した。
執筆:静岡県立静岡がんセンター 消化器内科 副医長 伏木 邦博 先生
監修:北海道大学病院 消化器内科 助教 結城 敏志 先生
監修:北海道大学病院 消化器内科 助教 結城 敏志 先生