| 対象疾患 | 治療ライン | 研究の相 | 評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| HER2陽性 胃/食道胃接合部癌 |
三次治療以降 | 第2相 | 奏効割合 | 日本・韓国 | あり |
試験名 :DESTINY-Gastric01
レジメン:トラスツズマブ デルクステカン vs 主治医選択の化学療法 (イリノテカン or パクリタキセル)
登録期間:2017年11月〜2019年5月
背景
ToGA試験の結果より、HER2陽性の胃/食道胃接合部癌に対する化学療法+トラスツズマブ(Tmab)併用療法は化学療法単独と比較し、有意に生存期間の延長を示し、同対象に対して推奨される一次化学療法として認識されている。二次治療以降に関してはHER2発現の有無にかかわらず、パクリタキセル(PTX)+ラムシルマブ(Ram)(二次:RAINBOW試験)、ニボルマブ (三次以降:ATTRACTION-2試験)、FTD/TPI(三次以降:TAGS試験)などが推奨されているが、特に三次治療以降に関しては、両剤ともプラセボと比較して有意な生存期間の延長を示したものの、臨床的に満足できる結果とまでは至っていない。更にはTmab以外にもいくつかの抗HER2標的薬剤(ペルツズマブ(PER)・ラパチニブ(LPT)・トラスツズマブ エムタンシン(T-DM1))の検証試験が行われたが、いずれも全生存期間の延長を示すことはできなかった1)-4)。
トラスツズマブ デルクステカンはヒト化抗HER2モノクローナル抗体と殺細胞性トポイソメラーゼI阻害薬(薬物ペイロード)を切断可能なテトラペプチドベースのリンカーで結合した抗体薬物複合体であり、米国・日本においてHER2陽性転移性乳癌に対して承認されている。HER2陽性の胃/食道胃接合部癌 44例を対象に行った第1相試験はトラスツズマブ デルクステカン 5.4mg/kgまたは6.4mg/kgで行われ、担当医評価による客観的奏効割合 43.2%、奏効期間中央値 7.0ヶ月、無増悪生存期間中央値 5.6ヶ月と有効性を示した。中でもトポイソメラーゼI阻害薬であるイリノテカン投与後の症例における奏効割合は41.7%を示し、トラスツズマブ デルクステカンのペイロードとの交差耐性が最小限であることを示唆した。
よって、Tmabを含む2レジメン以上の治療に不応となったHER2陽性の進行胃/食道胃接合部癌患者を対象として、トラスツズマブ デルクステカンと主治医選択の化学療法(IRIまたはPTX)の有効性を比較検討する非盲検多施設共同第2相試験を実施した。
シェーマ
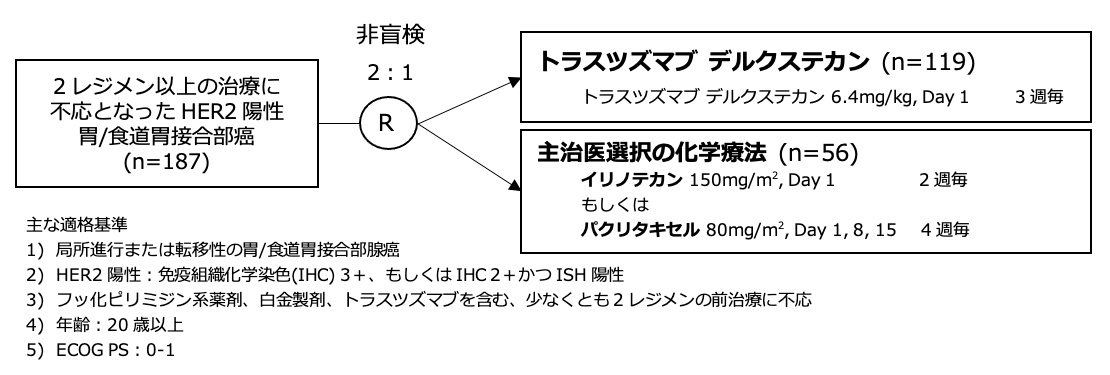
- 本試験では上記の主要コホートの他にHER2低発現(IHC 2+かつISH陰性、IHC 1+)を対象とした2つの探索コホートも行われたが、本論文では結果報告がなされていないため、詳細は割愛する。
統計学的事項
主要評価項目:奏効割合(中央判定)
トラスツズマブ デルクステカン群の奏効割合を40%、主治医選択の化学療法群の奏効割合を15%と推定し、両側α=0.05、検出力92.9%で必要症例数を設定したところ、180例(トラスツズマブ デルクステカン群 120例・主治医選択の化学療法群 60例)の登録が必要とされた。全生存期間は主要評価項目が有意であった場合に段階的に評価される重要な副次的評価項目であり、ハザード比 0.61(主治医選択の化学療法群 5.5ヶ月、トラスツズマブ デルクステカン群 9.0ヶ月:64%の向上)を検出するために、両側α=0.05、検出力80%で算出すると約133例の死亡イベントが必要とされた。
試験結果:
- 主要コホートには2017年11月から2019年5月までに日本 48施設、韓国 18施設から188例が無作為割付され、187例が治療を受けた(トラスツズマブ デルクステカン n=125、主治医選択の化学療法 n=62 [IRI n=55、PAC n=7])。トラスツズマブ デルクステカン群の1例は治療開始前の心エコーで異常を指摘され、不適格となり、治療を受けなかった。
- データカットオフ(2019年11月8日)時点でトラスツズマブ デルクステカン群の22%の症例、主治医選択の化学療法群の5%が治療継続されていた。
1. 患者背景
| N (%) | トラスツズマブ デルクステカン (N=125) |
主治医選択の化学療法 (N=62) |
|
|---|---|---|---|
| 年齢 | 中央値 (範囲) | 65 (34-82) | 66 (28-82) |
| 性別 | 女性 | 30 (24) | 15 (24) |
| 国 | 日本 韓国 |
99 (79) 26 (21) |
50 (81) 12 (19) |
| ECOG PS | 0 1 |
62 (50) 63 (50) |
30 (48) 32 (52) |
| 組織型 | Intestinal Diffuse その他 |
89 (71) 28 (22) 8 (6) |
38 (61) 18 (29) 6 (10) |
| HER2発現 | IHC 3+ IHC 2+ or ISH陽性 |
96 (77) 29 (23) |
47 (76) 15 (24) |
| 原発部位 | 胃 食道胃接合部 |
108 (86) 17 (14) |
55 (89) 7 (11) |
| 測定可能病変の径和 | 5cm未満 5cm以上 10cm未満 10cm以上 データ欠損 |
63 (50) 34 (27) 22 (18) 6 (5) |
26 (42) 22 (35) 8 (13) 6 (10) |
| 進行/転移性病変に 対する前治療数 |
2レジメン 3レジメン 4レジメン以上 |
66 (53) 34 (27) 25 (20) |
38 (61) 18 (29) 6 (10) |
| 前治療薬剤 | トラスツズマブ タキサン ラムシルマブ イリノテカン・他のトポイソメラーゼI阻害薬 免疫チェックポイント阻害薬 |
125 (100) 105 (84) 94 (75) 8 (6) 44 (35) |
62 (100) 55 (89) 41 (66) 5 (8) 17 (27) |
- 患者背景は両群間でバランスがとれていた。
- T-mab最終投与からの期間中央値はトラスツズマブ デルクステカン群 5.9ヶ月(範囲0.7-40.7)、主治医選択の化学療法群 6.5ヶ月(範囲 0.7-23.0)であった。
2. 奏効割合*(主要評価項目, 中央判定)
| トラスツズマブ デルクステカン (n=119) | 主治医選択の化学療法 (n=56) | p値 | |
|---|---|---|---|
| CR PR SD PD 評価不能 |
11 (9%) 50 (42%) 42 (35%) 14 (12%) 2 (2%) |
0 (0%) 8 (14%) 27 (48%) 17 (30%) 4 (7%) |
― |
| 奏効割合 (95%信頼区間) |
61 (51%) (42-61) |
8 (14%) (6-26) |
<0.001 |
* 奏効割合:CR+PRの割合
- 国・前治療歴・年齢・性別・ECOG PS・HER2 status・原発部位・組織型・転移臓器個数・胃切除歴によるサブ解析では、HER2 3+例(58%)でHER2 2+かつISH陽性例(29%)よりも良好な奏効割合を示したが、主治医選択の化学療法群と比較すると一貫してトラスツズマブ デルクステカン群で良好であった。
3. 奏効割合・病勢制御割合(Confirmed)**
| トラスツズマブ デルクステカン (n=119) | 主治医選択の化学療法 (n=56) | |
|---|---|---|
| CR PR SD PD 評価不能 |
10 (8%) 41 (34%) 51 (43%) 14 (12%) 3 (3%) |
0 (0%) 7 (12%) 28 (50%) 17 (30%) 4 (7%) |
| 奏効割合(Confirmed) (95%信頼区間) |
51 (43%) (34-52) |
7 (12%) (5-24) |
| 奏効期間(Confirmed) (95%信頼区間) |
11.3ヶ月 (5.6-算出不能) |
3.9ヶ月 (3.0-4.9) |
| 奏効までの時間(Confirmed) (95%信頼区間) |
1.5ヶ月 (1.4-1.7) |
1.6ヶ月 (1.3-1.7) |
| 病勢制御割合(Confirmed) (95%信頼区間) |
102 (86%) (78-91) |
35 (62%) (49-75) |
** 奏効割合(Confirmed):最初のCR/PRから4週間以上持続した症例の割合
病勢制御割合(Confirmed):奏効(Confirmed)+SDの割合
- トラスツズマブ デルクステカン群では80%以上の症例で腫瘍縮小を認めたが、主治医選択の化学療法群で腫瘍縮小を認めたのは約50%だった。
4. 全生存期間
| N | イベント | 中央値 (95%信頼区間) | 6ヶ月生存割合 | 12ヶ月生存割合 | |
|---|---|---|---|---|---|
| トラスツズマブ デルクステカン |
125 | 62/125 (50%) |
12.5ヶ月 (9.6-14.3) |
80% | 52% |
| 主治医選択の化学療法 | 62 | 39/62 (63%) |
8.4ヶ月 (6.9-10.7) |
66% | 29% |
HR 0.59 (95%信頼区間 0.39-0.88), p=0.01
- 国・前治療歴・年齢・性別・ECOG PS・HER2 status・原発部位・組織型・転移臓器個数・胃切除歴によるサブ解析では、主治医選択の化学療法群と比較するとほとんどのサブグループでトラスツズマブ デルクステカン群で良好であった(HER2 2+かつISH陽性例のみハザード比は1を超えた[HR 1.14(95%信頼区間 0.52-2.50)]。
5. 無増悪生存期間(中央判定)
| N | イベント | 中央値 (95%信頼区間) | 6ヶ月PFS割合 | 12ヶ月PFS割合 | |
|---|---|---|---|---|---|
| トラスツズマブ デルクステカン |
125 | 73/125 (58%) |
5.6ヶ月 (4.3-6.9) |
43% | 30% |
| 主治医選択の化学療法 | 62 | 36/62 (58%) |
3.5ヶ月 (2.0-4.3) |
21% | 0% |
HR 0.47 (95%信頼区間 0.31-0.71)
6. トラスツズマブ デルクステカン群で20%以上に発症した有害事象 (CTCAE v4.03)
| N (%) | トラスツズマブ デルクステカン (n=125) | 主治医選択の化学療法 (n=62) | ||||
|---|---|---|---|---|---|---|
| 全Grade | Grade 3 | Grade 4 | 全Grade | Grade 3 | Grade 4 | |
| 悪心 | 79 (63) | 6 (5) | 0 | 29 (47) | 1 (2) | 0 |
| 好中球数減少 | 79 (63) | 48 (38) | 16 (13) | 22 (35) | 10 (16) | 5 (8) |
| 食欲不振 | 75 (60) | 21 (17) | 0 | 28 (45) | 8 (13) | 0 |
| 貧血 | 72 (58) | 47 (38) | 0 | 19 (31) | 13 (21) | 1 (2) |
| 血小板数減少 | 49 (39) | 12 (10) | 2 (2) | 4 (6) | 1 (2) | 1 (2) |
| 白血球減少 | 47 (38) | 26 (21) | 0 | 22 (35) | 5 (8) | 2 (3) |
| 倦怠感 | 43 (34) | 1 (1) | 0 | 10 (16) | 0 | 0 |
| 下痢 | 40 (32) | 3 (2) | 0 | 20 (32) | 1 (2) | 0 |
| 嘔吐 | 33 (26) | 0 | 0 | 5 (8) | 0 | 0 |
| 便秘 | 30 (24) | 0 | 0 | 14 (23) | 0 | 0 |
| 発熱 | 30 (24) | 0 | 0 | 10 (16) | 0 | 0 |
| 脱毛症 | 28 (22) | 0 | 0 | 9 (15) | 0 | 0 |
| 疲労 | 27 (22) | 9 (7) | 0 | 15 (24) | 2 (3) | 0 |
| リンパ球数減少 | 27 (22) | 8 (6) | 6 (5) | 2 (3) | 0 | 1 (2) |
- 発熱性好中球減少症:トラスツズマブ デルクステカン群 6例(全例Grade 3) vs 主治医選択の化学療法群 2例(Grade 3 n=1, Grade 4 n=1)。
- トラスツズマブ デルクステカン群で1例の治療関連死亡があった(肺炎)。本事象は6サイクル投与後に生じ、発生時点で好中球数減少は生じていなかった。肺炎の詳しい原因に関しては報告されなかった。一方、主治医選択の化学療法群では治療関連死亡は認めなかった。
- トラスツズマブ デルクステカン群の12例(10%)が、独立性評価委員会によって薬剤関連の間質性肺疾患/肺炎と判断された(初回発症までの期間中央値 84.5日, 範囲 36-638)。本事象はほとんどがGrade 1-2であった(Grade 1 n=3, Grade 2 n=6, Grade 3 n=2, Grade 4 n=1)。本解析時点で8例は軽快もしくは軽快傾向であり(期間中央値 57.0日)、3例が未軽快(Grade 1, 2, 4がそれぞれ1例)、1例が状況不明(Grade 2)であった。
- 左室駆出率低下や心不全は両群とも認めなかった。
7. 投与状況
| トラスツズマブ デルクステカン (n=125) | 主治医選択の化学療法 (n=62) | |
|---|---|---|
| 有害事象による治療中止 | 15% | 6% |
| 有害事象による投与延期 | 62% | 37% |
| 有害事象による減量 | 32% | 34% |
- 治療期間中央値はトラスツズマブ デルクステカン群 4.6ヶ月(範囲 0.7-22.3)、主治医選択の化学療法群 2.8ヶ月(範囲 0.5-13.1)であった。
8. 後治療
- 試験治療終了後、後治療を受けたのはトラスツズマブ デルクステカン群 60例(48%)、主治医選択の化学療法群 46例(74%)であった。後治療として抗PD-1阻害薬を投与されたのは、トラスツズマブ デルクステカン群 31%、主治医選択の化学療法群 45%であった。
監修:近畿大学医学部 内科学教室 腫瘍内科部門 医学部講師 川上 尚人 先生