| 対象疾患 | 治療ライン | 研究の相 | 評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| HER2陽性 胃癌/食道胃接合部癌 |
一次治療 | 第2相 | 奏効割合 | 国内 | あり |
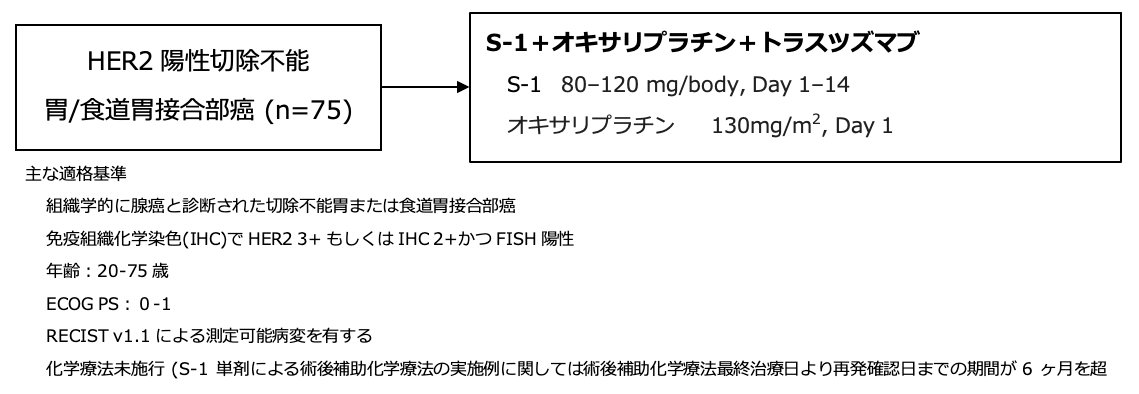
試験名 :HIGHSOX
レジメン:S-1+オキサリプラチン+トラスツズマブ
登録期間:2015年6月〜2018年1月
背景
進行胃癌ではHER2の増幅やタンパク過剰発現が最大20%の症例で観察される。
HER2陽性切除不能進行・再発胃癌初回治療例を対象としたToGA試験において、カペシタビン+シスプラチン療法(XP)または5-FU+シスプラチン療法(FP)へのトラスツズマブ(Tmab)の併用は全生存期間を有意に延長し、ToGA試験の後、進行胃癌はHER2 statusによって異なる治療方針が選択されるようになった。
HER2陰性進行胃癌ではシスプラチン(CDDP)+フッ化ピリミジン系薬剤の併用療法が標準的一次化学療法である。REAL-2試験は5-FUとCape、CDDPとOXを比較する2x2デザインの無作為化比較第3相試験であるが、全生存期間に関してCDDPに対するOXの非劣性が示された。本邦ではFP療法とS-1+オキサリプラチン併用療法を比較するG-SOX試験*が実施され、無増悪生存期間に関してS-1+CDDP併用療法に対するS-1+オキサリプラチン併用療法(SOX)の非劣性が示され、全生存期間は両群間で同等であった。血液毒性/消化管毒性/腎障害をはじめとした有害事象の管理はCDDPよりもOXで管理しやすいため、Cape or S-1+OX併用療法(CapeOX or SOX)がHER2陰性胃癌に対する標準治療として広く用いられている。
HER2陽性胃癌に対して、S-1+CDDP+Tmab療法はいくつかの第2相試験(HERBIS-1試験・WJOG7212G試験)で有効性と安全性が検証されているが、OX+フッ化ピリミジン系薬剤+Tmab併用療法に関して有効性と安全性を報告した研究は少ない(Ryu MH, et al.)。一方、HER2陰性胃癌に対して、いくつかの研究ではOX 130mg/m2を用いるSOXレジメン(SOX130)の有効性と安全性が示されているが1)2)、SOX130+Tmab併用療法の臨床データは存在しなかった。
よって、HER2陽性進行胃癌症例を対象にSOX130+Tmab併用療法の安全性と有効性を検証する目的に本試験を実施した。
*本レジメンの有効性と安全性を検証したG-SOX試験において、OXの投与量は100mg/m2である。
シェーマ
統計学的事項
主要評価項目:奏効割合 (担当医評価)
画像評価は病勢進行まで6週間毎にCTで測定され、CRおよびPRは初回確認から4週間後に評価され、確定された。ToGA試験、およびS-1+CDDP+Tmab併用療法の第2相試験(HERBIS-1試験・WJOG7212G試験)の結果から、SOX130+Tmab併用療法の閾値奏効割合を50%、期待奏効割合を65%とした。片側α=0.1、検出力90%とし、必要症例数は71例と算出された。若干の不適格症例を見込み、目標症例数は75例と算出された。
試験結果:
- 2015年6月から2018年1月の間に、日本国内10施設から78例が登録された。
- 適格基準を満たさなかった3例(不十分な臓器機能 n=1, 75歳を超える n=1, 心筋梗塞の既往 n=1)を除外した75例をfull analysis set(FAS)として有効性の解析が行われた。
1. 患者背景
| N (%) | N=75 | |
|---|---|---|
| 年齢(歳) | 中央値 範囲 |
64 21-75 |
| 性別 | 男性 女性 |
59 (78.7) 16 (21.3) |
| ECOG PS | 0 1 |
57 (76.0) 18 (24.0) |
| 疾患状態 | 切除不能進行例 再発例 |
66 (88.0) 9 (12.0) |
| 原発部位 | 胃 食道胃接合部 |
64 (85.3) 11 (14.7) |
| 組織型 | 分化型 未分化型 |
46 (61.3) 29 (38.6) |
| 胃切除歴 | あり なし |
10 (13.3) 65 (86.7) |
| 転移臓器個数 | 中央値 範囲 |
1 1-5 |
| 転移臓器 | リンパ節 肝 腹膜 肺 骨 その他 (副腎・胸膜・卵巣) |
40 (53.3) 35 (46.7) 20 (26.7) 9 (12.0) 3 (4.0) 8 (10.7) |
| HER2 status | IHC 3+ IHC 2+ かつ FISH陽性 |
55 (73.3) 20 (26.7) |
2. 奏効割合(主要評価項目, 担当医評価)・病勢制御割合
| n=75 | 95%信頼区間 | |
|---|---|---|
| CR PR SD PD NE |
1 (1.3%) 52 (69.3%) 17 (22.7%) 4 (5.3%) 1 (1.3%) |
― |
| 奏効割合 | 70.7% | (59.0-80.6) |
| 病勢制御割合 | 93.3% | (85.1-97.8) |
- 主要評価項目の帰無仮説(奏効割合 50%)は棄却された。
- PDだった4例を除いて、その他の症例は少なからず腫瘍縮小を示した。
3. 無増悪生存期間
| N | 中央値 (95%信頼区間) |
6ヶ月無増悪生存割合 (95%信頼区間) |
1年無増悪生存割合 (95%信頼区間) |
|---|---|---|---|
| 75 | 8.8ヶ月 (7.4-12.2) |
68.5% (56.4-77.8) |
39.5% (27.5-51.2) |
4. 全生存期間
| N | 中央値 (95%信頼区間) |
1年生存割合 (95%信頼区間) |
2年生存割合 (95%信頼区間) |
|---|---|---|---|
| 75 | 18.1ヶ月 (15.6-26.5) |
77.2% (65.4-85.4) |
43.0% (29.9-55.4) |
- 生存例における観察期間中央値は15.6ヶ月であった。
5. 投与状況
- 治療サイクル中央値:8サイクル(範囲:1-36)
- 2018年8月31日の最終フォロー後の解析段階で11例(15%)が治療継続中であった。
- 主な治療中止理由は、病勢進行(n=39, 61%)、続いて21日以上の投与延期(n=9, 14%)であった。21日以上の投与延期理由は好中球数減少(n=4)、血小板数減少(n=1)、AST/ALT増加(n=1)、クレアチニン増加(n=1)、肺炎(n=1)であった。
- 有害事象により治療中止に至ったのは4例であった(肝機能障害、下痢、血小板数減少、末梢性感覚ニューロパチー)。
- 少なくとも3サイクルの治療後に微小転移を生じた8名(リンパ節 n=3、腹膜 n=3、肝 n=2)が外科的切除を受けた。
- 44名(58.7%)が二次化学療法を受け、その内、39例がタキサンまたはイリノテカンを含む治療を受けた。
[8サイクルまでの相対用量強度]
| S-1 | OX | Tmab | |
|---|---|---|---|
| 中央値 (四分位範囲) |
75.0% (46.9-97.9) |
59.6% (42.3-83.5) |
96.0% (52.0-100.0) |
6. サブ解析
[HER2 status別の解析]
| N | 全生存期間*中央値 | 奏効割合 | |
|---|---|---|---|
| IHC 3+ IHC 2+ かつ FISH陽性 |
55 20 |
20.5ヶ月 16.9ヶ月 |
70.9% 70.0% |
* HR 0.734 (95%信頼区間 0.366-1.475)
[OX 8サイクルまでの相対用量強度別解析]
| 相対用量強度 | 奏効割合 | 無増悪生存期間 中央値 | 全生存期間 中央値 |
|---|---|---|---|
| Low (<50%) Middle (50-75%) High (>75%) |
51.7% 72.7% 91.7% |
8.7ヶ月 8.8ヶ月 9.8ヶ月 |
20.5ヶ月 18.1ヶ月 17.7ヶ月 |
| p値 | 0.0062* 0.0015** |
0.5400*** | 0.8861*** |
* General Association, ** Trend, *** Homogeneity
7. 有害事象(CTCAE ver4.0)
| N (%) | 全Grade | Grade 3-4 |
|---|---|---|
| 全有害事象 | 74 (98.6) | 34 (45.3) |
| 血液学的有害事象 白血球減少 好中球数減少 発熱性好中球減少症 貧血 血小板数減少 |
25 (33.3) 59 (78.7) 0 (0) 72 (96.0) 59 (78.7) |
1 (1.3) 8 (10.7) 0 (0) 5 (6.7) 1 (1.3) |
| 非血液学的有害事象 血中ビリルビン増加 AST増加 ALT増加 クレアチニン増加 LVEF減量 末梢性感覚ニューロパチー 下痢 食欲不振 悪心 嘔吐 疲労 倦怠感 便秘 口腔粘膜炎 浮腫 血栓塞栓症 注射部位反応 発熱 低アルブミン血症 味覚異常 皮膚および皮下組織障害 |
14 (18.7) 69 (92.0) 45 (60.0) 6 (8.0) 8 (10.7) 63 (84.0) 39 (52.0) 58 (77.3) 49 (65.3) 15 (20.0) 43 (57.3) 5 (6.7) 17 (22.7) 19 (25.3) 6 (8.0) 3 (4.0) 8 (10.7) 6 (8.0) 14 (18.7) 11 (14.3) 10 (11.3) |
1 (1.3) 2 (2.7) 3 (4.0) 0 (0) 2 (2.7) 12 (16.0) 5 (6.7) 4 (5.3) 3 (4.0) 3 (4.0) 2 (2.7) 2 (2.7) 1 (1.3) 1 (1.3) 1 (1.3) 1 (1.3) 1 (1.3) 1 (1.3) 0 (0) 0 (0) 0 (0) |
- 最初の6例において2サイクルまでの安全性を独立効果安全性評価委員会で評価した結果、治療が初期用量で許容できると判断し、試験継続を承認した。
- Grade 3以上のインフュージョンリアクション、心不全は観察されず、治療関連死亡も認めなかった。
[有害事象による各薬剤の減量・投与中断・投与中止]
| N (%) | 減量 | 投与中断 | 投与中止 |
|---|---|---|---|
| S-1 | 41 (54.6) | 38 (50.6) | 14 (18.6) |
| OX | 38 (50.6) | 35 (46.6) | 22 (29.3) |
| Tmab | 8 (10.6) | 30 (40.0) | 0 (0) |
監修:近畿大学医学部 内科学教室 腫瘍内科部門 医学部講師 川上 尚人 先生